Kako izjednačiti koeficijente u hemijskoj jednačini. Informaciona kartica. "Algoritam za sređivanje koeficijenata u jednačinama hemijskih reakcija."
U lekciji 13 "" iz kursa " Hemija za lutke» razmotriti zašto su potrebne hemijske jednačine; Naučimo kako izjednačiti kemijske reakcije pravilnim rasporedom koeficijenata. Ova lekcija će zahtijevati od vas da znate osnovnu hemiju iz prethodnih lekcija. Obavezno pročitajte o elementarnoj analizi za dubinski pogled na empirijske formule i hemijsku analizu.
Kao rezultat reakcije sagorijevanja metana CH 4 u kisiku O 2 nastaju ugljični dioksid CO 2 i voda H 2 O. Ova reakcija se može opisati hemijska jednačina:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Hajde da pokušamo da izvučemo više informacija iz hemijske jednačine nego samo indikacije proizvodi i reagensi reakcije. Hemijska jednadžba (1) je NEpotpuna i stoga ne pruža nikakvu informaciju o tome koliko se molekula O 2 potroši na 1 molekul CH 4 i koliko se molekula CO 2 i H2 O dobije kao rezultat. Ali ako zapišemo numeričke koeficijente ispred odgovarajućih molekularnih formula, koje pokazuju koliko molekula svake vrste učestvuje u reakciji, onda ćemo dobiti kompletna hemijska jednačina reakcije.
Da biste kompletirali sastav hemijske jednadžbe (1), morate zapamtiti jedno jednostavno pravilo: lijeva i desna strana jednačine moraju sadržavati isti broj atoma svake vrste, budući da tokom kemijske reakcije nema novih atoma stvoreni a postojeći se ne uništavaju. Ovo pravilo se zasniva na zakonu održanja mase, o kojem smo govorili na početku poglavlja.
Neophodan je da bi se iz jednostavne hemijske jednadžbe dobila potpuna. Dakle, prijeđimo na stvarnu jednadžbu reakcije (1): pogledajte još jednom hemijsku jednačinu, tačno na atome i molekule na desnoj i lijevoj strani. Lako je vidjeti da reakcija uključuje tri vrste atoma: ugljik C, vodonik H i kisik O. Hajde da izbrojimo i uporedimo broj atoma svake vrste na desnoj i lijevoj strani kemijske jednadžbe.
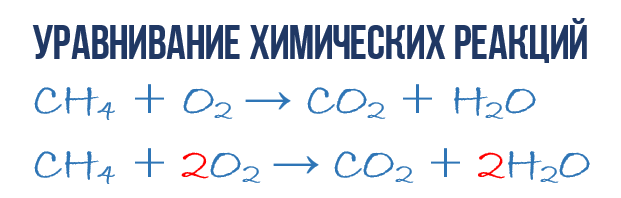
Počnimo sa ugljenikom. Na lijevoj strani, jedan C atom je dio molekule CH4, a na desnoj strani, jedan C atom je dio CO2. Dakle, na lijevoj i desnoj strani broj atoma ugljika je isti, pa ga ostavljamo na miru. Ali radi jasnoće, stavimo koeficijent 1 ispred molekula s ugljikom, iako to nije potrebno:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Zatim prelazimo na brojanje atoma vodika H. Na lijevoj strani se nalaze 4 H atoma (u kvantitativnom smislu, H 4 = 4H) u molekuli CH 4, a na desnoj strani su samo 2 H atoma u molekuli H 2 O molekula, što je dva puta manje nego na lijevoj strani hemijske jednačine (2). Hajde da izjednačimo! Da bismo to učinili, stavimo koeficijent 2 ispred molekule H 2 O. Sada ćemo imati 4 molekula vodika H u reaktantima i produktima:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Napominjemo da koeficijent 2, koji smo napisali ispred molekule vode H 2 O za izjednačavanje vodonika H, povećava 2 puta sve atome uključene u njegov sastav, odnosno 2H 2 O znači 4H i 2O. U redu, čini se da smo ovo riješili, ostaje samo da prebrojimo i uporedimo broj atoma kiseonika O u hemijskoj jednačini (3). Odmah vam pada u oči da je na lijevoj strani tačno 2 puta manje O atoma nego na desnoj. Sada već znate kako sami uravnotežiti kemijske jednadžbe, pa ću odmah zapisati konačni rezultat:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O ili CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Kao što vidite, izjednačenje hemijske reakcije Nije to tako škakljiva stvar, a ovdje nije važna hemija, već matematika. Jednačina (4) se zove potpuna jednačina hemijsku reakciju, jer se pridržava zakona održanja mase, tj. broj atoma svake vrste koji ulaze u reakciju tačno se poklapa sa brojem atoma ove vrste po završetku reakcije. Svaka strana ove potpune hemijske jednadžbe sadrži 1 atom ugljika, 4 atoma vodika i 4 atoma kisika. Međutim, vrijedi razumjeti par važne tačke: hemijska reakcija je složeni niz pojedinačnih međufaza, te je stoga nemoguće, na primjer, tumačiti jednačinu (4) u smislu da se 1 molekul metana mora istovremeno sudariti sa 2 molekula kisika. Procesi koji se dešavaju tokom formiranja produkta reakcije su mnogo složeniji. Druga tačka: potpuna jednačina reakcija nam ne govori ništa o njenom molekularnom mehanizmu, odnosno o slijedu događaja koji se dešavaju na molekularnom nivou tokom njenog nastanka.
Koeficijenti u jednadžbama hemijskih reakcija
Još jedan jasan primjer kako pravilno urediti kvote u jednačinama hemijskih reakcija: trinitrotoluen (TNT) C 7 H 5 N 3 O 6 se snažno kombinuje sa kiseonikom da bi formirao H 2 O, CO 2 i N 2. Zapišimo jednačinu reakcije koju ćemo izjednačiti:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Lakše je napraviti potpunu jednačinu zasnovanu na dva molekula TNT-a, budući da se na lijevoj strani nalazi neparan broj atomi vodika i dušika, a desno - čak:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Tada je jasno da se 14 atoma ugljika, 10 atoma vodika i 6 atoma dušika moraju pretvoriti u 14 molekula ugljičnog dioksida, 5 molekula vode i 3 molekula dušika:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Sada oba dijela sadrže isti broj svih atoma osim kisika. Od 33 atoma kiseonika prisutnih na desnoj strani jednačine, 12 se snabdevaju od dva originalna molekula TNT-a, a preostalih 21 mora davati 10,5 O 2 molekula. Tako će kompletna hemijska jednačina izgledati ovako:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Možete pomnožiti obje strane sa 2 i riješiti se necjelobrojnog koeficijenta 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Ali ne morate to raditi, jer svi koeficijenti jednačine ne moraju biti cijeli brojevi. Još bi ispravnije bilo napraviti jednačinu zasnovanu na jednom molekulu TNT-a:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Potpuna hemijska jednačina (9) sadrži mnogo informacija. Prije svega, to ukazuje na početne tvari - reagensi, i proizvodi reakcije. Osim toga, pokazuje da su tijekom reakcije svi atomi svake vrste pojedinačno očuvani. Ako pomnožimo obje strane jednačine (9) s Avogadrovim brojem N A = 6,022 10 23, možemo reći da 4 mola TNT-a reaguju sa 21 molom O 2 i formiraju 28 molova CO 2, 10 molova H 2 O i 6 molovi N 2.
Postoji još jedan trik. Pomoću periodnog sistema određujemo molekularne mase svih ovih supstanci:
- C 7 H 5 N 3 O 6 = 227,13 g/mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Sada će jednačina 9 također pokazati da 4 227,13 g = 908,52 g TNT-a zahtijeva 21 31,999 g = 671,98 g kisika da završi reakciju i kao rezultat se formira 28 44,010 g = 1232,3 g CO 2, 1015·18 = 10. g H2O i 6·28,013 g = 168,08 g N2. Provjerimo da li je zakon održanja mase zadovoljen u ovoj reakciji:
| Reagensi | Proizvodi | |
| 908,52 g TNT | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Ukupno | 1580,5 g | 1580,5 g |
Ali pojedinačni molekuli ne moraju nužno sudjelovati u kemijskoj reakciji. Na primjer, reakcija krečnjaka CaCO3 i hlorovodonične kiseline HCl da nastane vodena otopina kalcijevog klorida CaCl2 i ugljičnog dioksida CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Hemijska jednadžba (11) opisuje reakciju kalcijum karbonata CaCO 3 (vapnenac) i hlorovodonične kiseline HCl da nastane vodeni rastvor kalcijum hlorida CaCl 2 i ugljen dioksida CO 2. Ova jednadžba je potpuna, jer je broj atoma svake vrste na lijevoj i desnoj strani isti.
Značenje ove jednačine je makroskopski (molarni) nivo je kako slijedi: 1 mol ili 100,09 g CaCO 3 zahtijeva 2 mola ili 72,92 g HCl da završi reakciju, što rezultira 1 molom CaCl 2 (110,99 g/mol), CO 2 (44,01 g/mol) i H 2 O (18,02 g/mol). Iz ovih numeričkih podataka lako je potvrditi da je zakon održanja mase zadovoljen u ovoj reakciji.
Tumačenje jednačine (11) na mikroskopski (molekularni) nivo nije tako očigledno, budući da je kalcijum karbonat sol, a ne molekularno jedinjenje, pa se stoga hemijska jednačina (11) ne može razumjeti u smislu da 1 molekul kalcijum karbonata CaCO 3 reaguje sa 2 molekula HCl. Štaviše, molekul HCl u rastvoru generalno se disocira (raspada) na H + i Cl - jone. Tako više ispravan opis onoga što se dešava u ovoj reakciji na molekularnom nivou dato je jednadžbom:
- CaCO 3 (sol.) + 2H + (aq.) → Ca 2+ (aq.) + CO 2 (g.) + H 2 O (l.) (12)
Ovdje skraćeno u zagradama fizičko stanje svaka vrsta čestica ( TV- teško, aq.- hidratisani joni u vodenom rastvoru, G.- gas, i.- tečnost).
Jednačina (12) pokazuje da čvrsti CaCO 3 reaguje sa dva hidratizovana iona H +, formirajući pozitivne jone Ca 2+, CO 2 i H 2 O. Jednačina (12), kao i druge potpune hemijske jednadžbe, ne daje ideju o molekularni mehanizam reaguje i manje je pogodan za brojanje količine supstanci, međutim, daje najbolji opis dešava na mikroskopskom nivou.
Pojačajte svoje znanje o sastavljanju hemijskih jednadžbi tako što ćete sami raditi kroz primjer s rješenjem:
Nadam se od lekcije 13" Pisanje hemijskih jednadžbi„Naučio si nešto novo za sebe. Ako imate bilo kakvih pitanja, napišite ih u komentarima.
Učitelj je glavni glumac u organizovanju kognitivne aktivnosti učenika, stalno traži načine za poboljšanje efikasnosti učenja. Organizacija efikasne nastave moguća je samo uz poznavanje i vešto korišćenje različitih oblika pedagoškog procesa.
1. Moderan čovek mora imati ne samo zbir znanja i vještina, već i sposobnost da percipira svijet kao jedinstvenu, složenu cjelinu koja se stalno razvija.
Skinuti:
Pregled:
Članak o hemiji: “Raspored koeficijenata u hemijskim jednačinama”
Sastavio: nastavnik hemije
GBOU srednja škola br. 626
Kazutina O.P.
Moskva 2012
“Raspored koeficijenata u hemijskim jednačinama”
Nastavnik, kao glavni lik u organizovanju kognitivne aktivnosti učenika, stalno traži načine za poboljšanje efikasnosti nastave. Organizacija efikasne nastave moguća je samo uz poznavanje i vešto korišćenje različitih oblika pedagoškog procesa.
1. Moderna osoba mora imati ne samo zbir znanja i vještina, već i sposobnost da percipira svijet kao jedinstvenu, složenu cjelinu koja se stalno razvija.
Algoritam za pripremu za lekciju
odabir teme, definisanje ciljeva;
odabir sadržaja;
utvrđivanje sredstava i načina za razvijanje pozitivnog motivacionog stava učenika prema radu u učionici;
specifikacija opremanja časa potrebnim vizuelnim i didaktičkim materijalom;
razvoj plana časa
Primer časa hemije „Raspoređivanje koeficijenata u hemijskoj jednačini“ za nastavnike
Cilj: odgovorite na pitanje: "zašto treba da stavljate koeficijente u hemijsku jednačinu?"
Zadaci:
Problem potrebe za dodjeljivanjem koeficijenata
Algoritam za postavljanje koeficijenata
Dokaz značenja rasporeda koeficijenata
Tokom nastave:
Savremeni student, ako uči, pragmatistički se odnosi prema znanju koje dobija i obrađuje. Stoga bi vam materijal koji ste dobili trebao stati u glavu logično i sažeto.
Da bi se to postiglo, nastavnik uvijek treba obratiti pažnju Za što jedna ili ona radnja se mora naučiti na času. To jest, nastavnik mora objasniti. A onda, na dobar način, sačekajte prava pitanja na novu temu.
Zakon održanja mase supstanci
Čuveni engleski hemičar R. Boyle, kalcinirajući različite metale u otvorenoj retorti i vagajući ih prije i poslije zagrijavanja, otkrio je da masa metala postaje veća. Na osnovu ovih eksperimenata nije uzeo u obzir ulogu zraka i izveo je netačan zaključak da se masa tvari mijenja kao rezultat kemijskih reakcija. R. Boyle je tvrdio da postoji neka vrsta "vatrene materije", koja se, kada se metal zagreje, kombinuje sa metalom, povećavajući njegovu masu.
Mg + O 2 MgO
24 g 40 g
M.V. Lomonosov, za razliku od R. Boylea, kalcinirao je metale ne na otvorenom, već u zatvorenim retortama i vagao ih prije i poslije kalcinacije. On je dokazao da masa supstanci prije i poslije reakcije ostaje nepromijenjena i da se prilikom kalcinacije metalu dodaje dio zraka. (U to vrijeme kisik još nije bio otkriven.) Rezultate ovih eksperimenata je formulirao u obliku zakona: „Sve promjene koje se događaju u prirodi su takva stanja da se sve što se uzme iz jednog tijela dodaje drugom.” Trenutno je ovaj zakon formuliran na sljedeći način:
Masa tvari koje su ušle u kemijsku reakciju jednaka je masi nastalih tvari
Mg + O 2 MgO
24 g 32 g 40 g
Pitanje: zakon nije ispunjen (jer mase početne i konačne supstance nisu jednake).
Rješenje ovog problema je raspored koeficijenata (cijeli brojevi koji označavaju broj molekula):
2Mg + O 2 2MgO
48 g 32 g 80 g – mase prije i poslije su jednake zbog činjenice da je i broj atoma elemenata jednak prije i poslije reakcije.
Tako, dokazavši učenicima potrebu za izjednačavanjem masenih koeficijenata, možete i bez neke od prethodnih tema: sastavljanje formula za supstance po valentnosti, izračunavanje mase, količine supstance... Takođe priča o tome da je zakon očuvanja mase materije „ponovo je otkrio” 20 godina kasnije A. Lavoisier, razjasnivši to s jedne strane, ali potpuno ne obraćajući pažnju na M.V. Lomonosov sa etikom, možete to ostaviti samostalno učenje u obliku izvještaja, na primjer.
Dakle, da biste uspješno završili zadatke ove vrste, morate razumjeti uvjet: broj atoma prije reakcije db jednak je broju atoma nakon reakcije: riješimo zajedno:
H 2 S + 3O 2 SO 2 + 2H 2 O (udvostručujemo kisik sa desne strane. Brojimo ih na lijevoj strani)
CH 4 + 2O 2 CO 2 + 2H 2 O
Koeficijente smo smjestili u jednačine sagorijevanja dva plina
Danas ćemo govoriti o tome kako postaviti koeficijente u hemijske jednačine. Ovo pitanje zanima ne samo srednjoškolce. obrazovne institucije, ali i za momke koji se tek upoznaju sa osnovnim elementima kompleksa i zanimljiva nauka. Ako shvatite u prvoj fazi, problemi sa rješavanjem problema se neće pojaviti u budućnosti. Hajde da to shvatimo od samog početka.
Šta je jednačina
Obično se shvata kao konvencionalno snimanje hemijske reakcije koja se dešava između odabranih reagensa. Za takav proces koriste se indeksi, koeficijenti i formule.
Algoritam kompilacije
Kako napisati hemijske jednačine? Primjeri bilo koje interakcije mogu se napisati zbrajanjem originalnih veza. Znak jednakosti označava da dolazi do interakcije između supstanci koje reaguju. Zatim se formula proizvoda sastavlja prema valentnosti (oksidacijskom stanju).
Kako snimiti reakciju
Na primjer, ako trebate zapisati kemijske jednadžbe koje potvrđuju svojstva metana, odaberite sljedeće opcije:
- halogeniranje (radikalna interakcija sa elementom VIIA periodni sistem D. I. Mendeljejev);
- sagorevanje u kiseoniku vazduha.
Za prvi slučaj na lijevoj strani pišemo početne tvari, a na desnoj strani rezultirajuće proizvode. Nakon provjere broja atoma svakog hemijskog elementa, dobijamo konačan zapis procesa koji je u toku. Kada metan sagorijeva u kisiku, dolazi do egzotermnog procesa koji rezultira stvaranjem ugljičnog dioksida i vodene pare.
Da bi se pravilno postavili koeficijenti u hemijskim jednačinama, koristi se zakon održanja mase supstanci. Proces izjednačavanja započinjemo određivanjem broja atoma ugljika. Zatim vršimo proračune za vodonik i tek nakon toga provjeravamo količinu kisika.
OVR
Kompleksne hemijske jednadžbe mogu se izbalansirati korišćenjem elektronske ravnoteže ili metode polureakcije. Nudimo niz akcija dizajniranih za dodjelu koeficijenata u sljedećim vrstama reakcija:
- raspadanje;
- zamjene.

Prvo, važno je urediti oksidaciona stanja svakog elementa u spoju. Prilikom njihovog uređenja potrebno je uzeti u obzir neka pravila:
- Za jednostavnu supstancu je nula.
- U binarnom spoju njihov zbir je 0.
- U spoju od tri ili više elemenata, prvi pokazuje pozitivnu vrijednost, najudaljeniji ion - negativno značenje stepen oksidacije. Centralni element se izračunava matematički, uzimajući u obzir da ukupan broj mora biti 0.
Zatim odaberite one atome ili ione čije se oksidacijsko stanje promijenilo. Znakovi plus i minus označavaju broj elektrona (primljenih, datih). Zatim se između njih određuje najmanji višekratnik. Kada se NOC podijeli ovim brojevima, dobiju se brojevi. Ovaj algoritam će biti odgovor na pitanje kako postaviti koeficijente u hemijske jednačine.
Prvi primjer
Recimo da je dat zadatak: „Rasporedite koeficijente u reakciji, popunite prazna polja, odredite oksidaciono sredstvo i redukciono sredstvo.“ Takvi primjeri se nude maturantima koji su odabrali hemiju kao svoj Jedinstveni državni ispit.
KMnO 4 + H 2 SO 4 + KBr = MnSO 4 + Br 2 +…+…

Pokušajmo razumjeti kako postaviti koeficijente u hemijske jednačine koje se nude budućim inženjerima i doktorima. Nakon sređivanja oksidacijskih stanja elemenata u polaznim materijalima i dostupnim proizvodima, nalazimo da ion mangana djeluje kao oksidacijsko sredstvo, a bromidni ion ispoljava redukcijska svojstva.
Zaključujemo da propuštene supstance ne učestvuju u redoks procesu. Jedan od proizvoda koji nedostaje je voda, a drugi će biti kalijum sulfat. Nakon sastavljanja elektronske ravnoteže, završna faza će biti postavljanje koeficijenata u jednačini.
Drugi primjer
Dajemo još jedan primjer da shvatimo kako postaviti koeficijente u hemijske jednadžbe redoks tipa.
Pretpostavimo da nam je dat sljedeći dijagram:
P + HNO 3 = NO 2 + … + …
Fosfor, koji je po definiciji jednostavna supstanca, pokazuje redukciona svojstva, povećavajući oksidaciono stanje na +5. Stoga će jedna od propuštenih supstanci biti fosforna kiselina H 3 PO 4. ORR pretpostavlja prisustvo redukcijskog agensa, a to će biti dušik. Pretvara se u dušikov oksid (4), stvarajući NO 2

Da bismo stavili koeficijente u ovu reakciju, napravićemo elektronski bilans.
P 0 daje 5e = P +5
N +5 uzima e = N +4
S obzirom da dušičnoj kiselini i dušičnom oksidu (4) mora prethoditi koeficijent 5, dobijamo gotovu reakciju:
P + 5HNO 3 = 5NO 2 + H 2 O + H 3 PO 4
Stereohemijski koeficijenti u hemiji omogućavaju rešavanje različitih računskih problema.
Treći primjer
S obzirom na to da raspored koeficijenata stvara poteškoće kod mnogih srednjoškolaca, potrebno je uvježbati redoslijed radnji na konkretni primjeri. Nudimo još jedan primjer zadatka, za čije je izvođenje potrebno poznavanje metodologije za sređivanje koeficijenata u redoks reakciji.
H 2 S + HMnO 4 = S + MnO 2 +…

Posebnost predloženog zadatka je da je potrebno dopuniti proizvod reakcije koji nedostaje i tek nakon toga se može pristupiti postavljanju koeficijenata.
Nakon raspoređivanja oksidacijskih stanja svakog elementa u spojevima, možemo zaključiti da mangan ispoljava oksidirajuća svojstva, smanjujući njegovu valenciju. Sposobnost redukcije u predloženoj reakciji pokazuje se sumporom koji se reducira na jednostavnu supstancu. Nakon sastavljanja elektronske ravnoteže, sve što treba da uradimo je da uredimo koeficijente u predloženom dijagramu procesa. I gotovo je.
Četvrti primjer
Hemijska jednačina se naziva potpunim procesom kada se u njoj u potpunosti poštuje zakon održanja mase tvari. Kako provjeriti ovaj obrazac? Broj atoma istog tipa koji su ušli u reakciju mora odgovarati njihovom broju u produktima reakcije. Samo u ovom slučaju će se moći govoriti o korisnosti zabilježene kemijske interakcije, mogućnosti njene upotrebe za izvođenje proračuna i rješavanje računskih problema različitim nivoima teškoće. Evo varijante zadatka koja uključuje postavljanje nedostajućih stereohemijskih koeficijenata u reakciju:
Si + …+ HF = H 2 SiF 6 + NO +…

Teškoća zadatka je u tome što nedostaju i početne supstance i produkti reakcije. Nakon podešavanja oksidacionih stanja svih elemenata, vidimo da atom silicija u predloženom zadatku pokazuje redukciona svojstva. Među produktima reakcije je prisutan dušik (II), jedan od polaznih spojeva je Azotna kiselina. Logično utvrđujemo da je proizvod koji nedostaje u reakciji voda. Završna faza će biti postavljanje rezultirajućih stereohemijskih koeficijenata u reakciju.
3Si + 4HNO 3 + 18HF = 3H 2 SiF 6 + 4NO + 8 H 2 O
Primjer problema jednadžbe
Potrebno je odrediti zapreminu 10% rastvora hlorovodonika, čija je gustina 1,05 g/ml, potrebna za potpunu neutralizaciju kalcijum hidroksida koji nastaje tokom hidrolize njegovog karbida. Poznato je da gas koji se oslobađa tokom hidrolize zauzima zapreminu od 8,96 litara (n.s.).Da biste se nosili sa zadatkom, prvo morate napraviti jednačinu za proces hidrolize kalcijum karbida:
CaC 2 + 2H 2 O = Ca (OH) 2 + C 2 H 2
Kalcijum hidroksid reaguje sa hlorovodonikom, dolazi do potpune neutralizacije:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

Izračunavamo masu kiseline koja će biti potrebna za ovaj proces. Odredite zapreminu rastvora hlorovodonika. Svi proračuni za problem se izvode uzimajući u obzir stereohemijske koeficijente, što potvrđuje njihovu važnost.
Konačno
Analiza rezultata jedinstvenog državnog ispita iz hemije ukazuje da zadaci koji se odnose na postavljanje stereohemijskih koeficijenata u jednadžbama, sastavljanje elektronske ravnoteže, određivanje oksidacionog agensa i redukcionog agensa izazivaju ozbiljne poteškoće savremenim maturantima. srednje škole. Nažalost, stepen samostalnosti savremenih maturanata je skoro minimalan, pa srednjoškolci ne praktikuju teorijsku osnovu koju predlaže nastavnik.
Među tipične greške Mnogo je matematičkih grešaka koje školarci prave prilikom sređivanja koeficijenata u reakcijama različitih vrsta. Na primjer, ne znaju svi kako pronaći najmanji zajednički višekratnik ili ispravno podijeliti i množiti brojeve. Razlog za ovu pojavu je smanjenje broja sati obrazovne škole da prouči ovu temu. At osnovni program u hemiji, nastavnici nemaju mogućnost da sa svojim učenicima rade na pitanjima koja se odnose na pripremu elektronske ravnoteže u redoks procesu.
Instrukcije
Prije nego što započnete sam zadatak, morate shvatiti da je broj koji se stavlja ispred hemijski element ili cijelu formulu koeficijenta. A cifra vrijedi (i neznatno) indeksa. Osim ovoga, to:
Koeficijent se odnosi na sve hemijske simbole koji se pojavljuju iza njega u formuli
Koeficijent se množi sa indeksom (ne zbraja se!)
Broj atoma svakog elementa tvari koje ulaze u reakciju mora se podudarati s brojem atoma ovih elemenata uključenih u produkte reakcije.
Na primjer, pisanje formule 2H2SO4 znači 4 atoma H (vodonika), 2 S (sumpora) atoma i 8 O (kiseonika) atoma.
1. Primjer br. 1. Razmotrimo sagorijevanje etilena.
Pri sagorevanju organska materija nastaju ugljični monoksid (IV) (ugljični dioksid) i voda. Pokušajmo s koeficijentom uzastopno.
C2H4 + O2 => CO2+ H2O
Počnimo sa analizom. U reakciju su ušla 2 atoma C (ugljika), ali je dobiven samo 1 atom, što znači da smo ispred CO2 stavili 2. Sada je njihov broj isti.
C2H4 + O2 => 2CO2+ H2O
Pogledajmo sada H (vodonik). 4 atoma vodika su ušla u reakciju, ali rezultat je bio samo 2 atoma, stoga smo stavili 2 ispred H2O (vode) - sada dobijamo i 4
C2H4 + O2 => 2CO2+ 2H2O
Brojimo sve atome O (kiseonika) nastale kao rezultat reakcije (to jest, nakon jednakosti). 4 atoma u 2CO2 i 2 atoma u 2H2O - ukupno 6 atoma. A prije reakcije postoje samo 2 atoma, što znači da smo stavili 3 ispred molekule kisika O2, što znači da ih je također 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Dakle, rezultat je isti broj atoma svakog elementa prije i poslije znaka jednakosti.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Primjer br. 2. Razmotrimo reakciju aluminija sa razrijeđenom sumpornom kiselinom.
Al + H2SO4 => Al2 (SO4) 3 + H2
Gledamo S atome uključene u Al2 (SO4) 3 - ima ih 3, ali u H2SO4 (sumporna kiselina) ima samo 1, stoga stavljamo i 3 ispred sumporne kiseline.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Ali sada ima 6 H (vodikova) atoma prije reakcije, a samo 2 nakon reakcije, što znači da stavljamo i 3 ispred molekule H2 (vodonika), tako da ukupno dobijemo 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Na kraju, pogledamo. Pošto u Al2 (SO4) 3 (aluminijum sulfatu) postoje samo 2 atoma aluminija, prije reakcije stavljamo 2 ispred Al (aluminij).
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Sada je broj svih atoma prije i poslije reakcije isti. Pokazalo se da sređivanje koeficijenata u hemijskim jednačinama nije tako teško. Samo vježbajte i sve će uspjeti.
Imajte na umu da se koeficijent množi s indeksom, a ne dodaje.
Izvori:
- kako elementi reaguju
- Test na temu" Hemijske jednadžbe»
Za mnoge školarce napišite jednačine hemijskih reakcija i pravilno ih postavite kvote nije lak zadatak. Štaviše, iz nekog razloga im je glavna poteškoća upravo drugi dio. Čini se da u tome nema ništa komplikovano, ali ponekad studenti odustanu, padaju u potpunu zbunjenost. Ali samo trebate zapamtiti nekoliko jednostavna pravila, a zadatak više neće stvarati poteškoće.
Instrukcije
Koeficijent, odnosno broj ispred formule molekula hemijska supstanca, na sve simbole, i pomnoženo sa svakim simbolom! To je množenje, a ne sabiranje! Možda se čini nevjerovatnim, ali neki učenici sabiraju dva broja umjesto da ih množe.
Broj atoma svakog elementa polaznih tvari (to jest, koji se nalazi na lijevoj strani jednadžbe) mora se podudarati s brojem atoma svakog elementa produkta reakcije (odnosno, koji se nalazi na njegovoj desnoj strani).
Najjednostavnija jednačina reakcije je:
Fe + S => FeS
Morate biti u stanju ne samo napisati jednačinu reakcije, već je i pročitati. Ova jednadžba, u svom najjednostavnijem obliku, glasi ovako: molekul željeza stupa u interakciju s molekulom sumpora, što rezultira jednim molekulom željeznog sulfida.
Najteža stvar u pisanju jednadžbe reakcije je kreiranje formula za produkte reakcije, tj. formirane supstance. Ovdje postoji samo jedno pravilo: formule molekula su građene striktno prema valentnosti njihovih sastavnih elemenata.
Osim toga, prilikom sastavljanja jednadžbi reakcije, treba zapamtiti zakon održanja mase tvari: svi atomi molekula polaznih tvari moraju biti uključeni u molekule produkta reakcije. Niti jedan atom ne bi trebao nestati ili se pojaviti neočekivano. Stoga, ponekad, nakon što ste napisali sve formule u jednadžbi reakcije, morate izjednačiti broj atoma u svakom dijelu jednadžbe - postaviti koeficijente. Evo primjera:
C + O 2 => CO 2Ovdje svaki element ima isti broj atoma i na desnoj i na lijevoj strani jednačine. Jednačina je spremna.
Cu+O 2 => CuO
I ovdje ima više atoma kisika na lijevoj strani jednačine nego na desnoj. Potrebno je dobiti toliko molekula bakrenog oksida
CuO , tako da sadrže isti broj atoma kiseonika, tj. 2. Dakle, formulaCuO postavljeni koeficijent 2:Cu+O2 => 2 CuO
Sada broj atoma bakra nije isti. Na lijevoj strani jednačine, ispred znaka bakra stavljamo koeficijent 2:
2 Cu + O2 => 2 CuO
Izračunajte da li postoji jednak broj atoma svakog elementa na lijevoj i desnoj strani jednačine. Ako da, onda je jednadžba reakcije tačna.
Još jedan primjer: Al+O 2 = Al 2 O 3
A evo i atoma svakog elementa različite količine prije i poslije reakcije. Počinjemo izravnavanje plinom - s molekulima kisika:
1) lijevo 2 atoma kiseonika, a desno je 3. Tražimo najmanji zajednički višekratnik ova dva broja. Ovo najmanji broj, koji je djeljiv sa 2 i 3, tj. 6. Prije formula kisika i aluminijevog oksidaAl 2 O 3 Takve koeficijente postavljamo tako da ukupan broj atoma kisika u ovim molekulima bude 6:
Al+ 3 O 2= 2 Al 2 O 3
2) Brojimo broj atoma aluminija: lijevo je 1 atom, a desno 2 atoma u dva molekula, tj. 4. Ispred aluminijskog znaka na lijevoj strani jednačine stavljamo koeficijent 4:
4Al + 3O 2 => 2 Al2O3
3) Još jednom brojimo sve atome prije i poslije reakcije: po 4 atoma aluminija i 6 atoma kisika.
Sve je u redu, jednačina reakcije je tačna. A ako se reakcija dogodi kada se zagrije, tada se iznad strelice postavlja dodatni znak t.
Jednačina hemijske reakcije je zapis napredovanja hemijske reakcije upotrebom hemijske formule i koeficijenti.

 Ulaz
Ulaz