Comment égaliser les coefficients dans une équation chimique. Fiche d'information. "Algorithme pour organiser les coefficients dans les équations de réactions chimiques."
Dans la leçon 13 "" du cours " Chimie pour les nuls» réfléchir à la raison pour laquelle des équations chimiques sont nécessaires ; Apprenons à égaliser les réactions chimiques en disposant correctement les coefficients. Cette leçon vous demandera de connaître la chimie de base des leçons précédentes. Assurez-vous de lire sur l'analyse élémentaire pour un examen approfondi des formules empiriques et de l'analyse chimique.
À la suite de la réaction de combustion du méthane CH 4 dans l'oxygène O 2, il se forme du dioxyde de carbone CO 2 et de l'eau H 2 O. Cette réaction peut être décrite équation chimique:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Essayons d'extraire plus d'informations d'une équation chimique qu'une simple indication produits et réactifs réactions. L'équation chimique (1) est INcomplète et ne fournit donc aucune information sur le nombre de molécules d'O 2 consommées pour 1 molécule de CH 4 et sur le nombre de molécules de CO 2 et H2 O obtenues en conséquence. Mais si nous écrivons des coefficients numériques devant les formules moléculaires correspondantes, qui indiquent combien de molécules de chaque type participent à la réaction, alors nous obtenons équation chimique complète réactions.
Afin de compléter la composition de l'équation chimique (1), vous devez vous rappeler une règle simple : les côtés gauche et droit de l'équation doivent contenir le même nombre d'atomes de chaque type, car lors de la réaction chimique, aucun nouvel atome n'est formé. ceux créés et existants ne sont pas détruits. Cette règle est basée sur la loi de conservation de la masse, dont nous avons parlé au début du chapitre.
C'est nécessaire pour en obtenir une complète à partir d'une simple équation chimique. Passons donc à l’équation de réaction (1) : jetez un autre regard à l’équation chimique, exactement aux atomes et aux molécules des côtés droit et gauche. Il est facile de voir que la réaction implique trois types d'atomes : le carbone C, l'hydrogène H et l'oxygène O. Comptons et comparons le nombre d'atomes de chaque type sur les côtés droit et gauche de l'équation chimique.
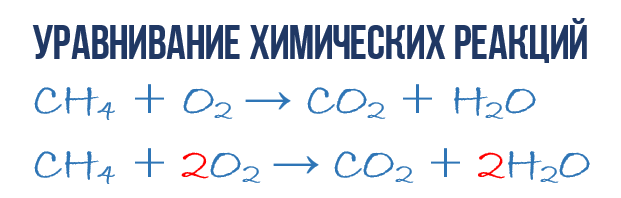
Commençons par le carbone. Sur le côté gauche, un atome de C fait partie de la molécule CH 4 et sur le côté droit, un atome de C fait partie de CO 2. Ainsi, sur les côtés gauche et droit, le nombre d’atomes de carbone est le même, donc nous le laissons tranquille. Mais pour plus de clarté, mettons un coefficient de 1 devant les molécules avec du carbone, bien que ce ne soit pas nécessaire :
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Ensuite, nous passons au comptage des atomes d'hydrogène H. Du côté gauche il y a 4 atomes H (au sens quantitatif, H 4 = 4H) dans la molécule CH 4, et du côté droit il n'y a que 2 atomes H dans la molécule. Molécule H 2 O, qui est deux fois inférieure à celle du côté gauche de l'équation chimique (2). Égalisons ! Pour ce faire, mettons un coefficient de 2 devant la molécule H 2 O. Nous aurons maintenant 4 molécules d'hydrogène H à la fois dans les réactifs et dans les produits :
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Veuillez noter que le coefficient 2, que nous avons écrit devant la molécule d'eau H 2 O pour égaliser l'hydrogène H, augmente de 2 fois tous les atomes qui le composent, c'est-à-dire 2H 2 O signifie 4H et 2O. Bon, il semble que nous ayons réglé ce problème, il ne reste plus qu'à compter et comparer le nombre d'atomes d'oxygène O dans l'équation chimique (3). On remarque immédiatement qu’il y a exactement 2 fois moins d’atomes d’oxygène du côté gauche que du côté droit. Maintenant que vous savez déjà comment équilibrer vous-même les équations chimiques, je vais donc immédiatement écrire le résultat final :
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O ou CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Comme vous pouvez le constater, la péréquation réactions chimiques Ce n’est pas si compliqué, et ce qui est important ici, ce n’est pas la chimie, mais les mathématiques. L'équation (4) est appelée équation complète réaction chimique, car elle obéit à la loi de conservation de la masse, c'est-à-dire le nombre d'atomes de chaque type qui entrent dans la réaction coïncide exactement avec le nombre d'atomes de ce type à la fin de la réaction. Chaque côté de cette équation chimique complète contient 1 atome de carbone, 4 atomes d'hydrogène et 4 atomes d'oxygène. Cependant, cela vaut la peine de comprendre quelques les points importants: une réaction chimique est une séquence complexe d'étapes intermédiaires individuelles, et il est donc impossible, par exemple, d'interpréter l'équation (4) dans le sens où 1 molécule de méthane doit entrer simultanément en collision avec 2 molécules d'oxygène. Les processus se produisant lors de la formation des produits de réaction sont beaucoup plus complexes. Deuxième point : équation complète La réaction ne nous dit rien sur son mécanisme moléculaire, c'est-à-dire sur la séquence d'événements qui se produisent au niveau moléculaire lors de son apparition.
Coefficients dans les équations de réactions chimiques
Un autre exemple clair de la façon d'organiser correctement chances dans les équations de réactions chimiques : le trinitrotoluène (TNT) C 7 H 5 N 3 O 6 se combine vigoureusement avec l'oxygène pour former H 2 O, CO 2 et N 2. Écrivons l'équation de réaction que nous égaliserons :
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Il est plus facile de créer une équation complète basée sur deux molécules de TNT, puisque le côté gauche contient nombre impair atomes d'hydrogène et d'azote, et à droite - même :
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Il est alors clair que 14 atomes de carbone, 10 atomes d'hydrogène et 6 atomes d'azote doivent se transformer en 14 molécules de dioxyde de carbone, 5 molécules d'eau et 3 molécules d'azote :
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Désormais, les deux parties contiennent le même nombre d’atomes, à l’exception de l’oxygène. Sur les 33 atomes d'oxygène présents du côté droit de l'équation, 12 sont fournis par les deux molécules de TNT d'origine, et les 21 restants doivent être fournis par 10,5 molécules d'O 2 . Ainsi, l’équation chimique complète ressemblera à :
- 2C 7 H 5 N 3 O 6 + 10,5 O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Vous pouvez multiplier les deux côtés par 2 et vous débarrasser du coefficient non entier 10,5 :
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Mais vous n’êtes pas obligé de le faire, car il n’est pas nécessaire que tous les coefficients de l’équation soient des nombres entiers. Il serait encore plus correct de créer une équation basée sur une molécule de TNT :
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
L'équation chimique complète (9) contient de nombreuses informations. Tout d'abord, il indique les substances de départ - réactifs, et des produits réactions. De plus, cela montre que lors de la réaction, tous les atomes de chaque type sont préservés individuellement. Si l'on multiplie les deux côtés de l'équation (9) par le nombre d'Avogadro N A = 6,022 10 23, on peut affirmer que 4 moles de TNT réagissent avec 21 moles d'O 2 pour former 28 moles de CO 2, 10 moles de H 2 O et 6 moles de N 2.
Il y a encore une astuce. À l'aide du tableau périodique, nous déterminons les masses moléculaires de toutes ces substances :
- C 7 H 5 N 3 O 6 = 227,13 g/mol
- O2 = 31,999 g/mole
- CO2 = 44,010 g/mole
- H2O = 18,015 g/mole
- N2 = 28,013 g/mole
Maintenant, l'équation 9 indiquera également que 4 227,13 g = 908,52 g de TNT nécessitent 21 31,999 g = 671,98 g d'oxygène pour terminer la réaction et, par conséquent, 28 44,010 g = 1232,3 g de CO 2 sont formés, 10·18,015 g = 180,15. g H2O et 6·28,013 g = 168,08 g N2. Vérifions si la loi de conservation de la masse est satisfaite dans cette réaction :
| Réactifs | Des produits | |
| 908,52 g de TNT | 1232,3 g de CO2 | |
| 671,98 g de CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Total | 1580,5 g | 1580,5 g |
Mais les molécules individuelles ne doivent pas nécessairement participer à une réaction chimique. Par exemple, la réaction du calcaire CaCO3 et de l'acide chlorhydrique HCl pour former une solution aqueuse de chlorure de calcium CaCl2 et de dioxyde de carbone CO2 :
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
L'équation chimique (11) décrit la réaction du carbonate de calcium CaCO 3 (calcaire) et de l'acide chlorhydrique HCl pour former une solution aqueuse de chlorure de calcium CaCl 2 et de dioxyde de carbone CO 2. Cette équation est complète puisque le nombre d’atomes de chaque type sur ses côtés gauche et droit est le même.
La signification de cette équation est niveau macroscopique (molaire) est la suivante : 1 mole ou 100,09 g de CaCO 3 nécessite 2 moles ou 72,92 g de HCl pour terminer la réaction, ce qui donne 1 mole de CaCl 2 (110,99 g/mol), CO 2 (44,01 g /mol) et H 2 O (18,02 g/mol). A partir de ces données numériques, il est facile de vérifier que la loi de conservation de la masse est satisfaite dans cette réaction.
Interprétation de l'équation (11) sur niveau microscopique (moléculaire) n'est pas si évident, puisque le carbonate de calcium est un sel, pas un composé moléculaire, et donc l'équation chimique (11) ne peut pas être comprise dans le sens où 1 molécule de carbonate de calcium CaCO 3 réagit avec 2 molécules de HCl. De plus, la molécule HCl en solution se dissocie (se désintègre) généralement en ions H + et Cl -. Tellement plus description correcte de ce qui se passe dans cette réaction au niveau moléculaire est donné par l'équation :
- CaCO 3 (sol.) + 2H + (aq.) → Ca 2+ (aq.) + CO 2 (g.) + H 2 O (l.) (12)
Abrégé ici entre parenthèses état physique chaque type de particule ( la télé- dur, aq.- ion hydraté en solution aqueuse, G.- gaz, et.- liquide).
L'équation (12) montre que le CaCO 3 solide réagit avec deux ions H + hydratés, formant les ions positifs Ca 2+, CO 2 et H 2 O. L'équation (12), comme d'autres équations chimiques complètes, ne donne pas une idée de le mécanisme moléculaire réagit et est moins pratique pour compter la quantité de substances, cependant, cela donne meilleure description se passe au niveau microscopique.
Renforcez vos connaissances sur la composition d'équations chimiques en travaillant vous-même sur un exemple avec une solution :
J'espère à partir de la leçon 13" Écrire des équations chimiques"Vous avez appris quelque chose de nouveau par vous-même. Si vous avez des questions, écrivez-les dans les commentaires.
L'enseignant, étant le principal acteur dans l'organisation de l'activité cognitive des élèves, recherche constamment des moyens d'améliorer l'efficacité de l'apprentissage. L'organisation d'un enseignement efficace n'est possible qu'avec la connaissance et l'utilisation habile des diverses formes du processus pédagogique.
1. L'homme moderne doit avoir non seulement la somme de connaissances et de compétences, mais aussi la capacité de percevoir le monde comme un tout unique, complexe et en constante évolution.
Télécharger:
Aperçu:
Article sur la chimie : « Disposition des coefficients dans les équations chimiques »
Compilé par : professeur de chimie
Lycée GBOU n°626
Kazutina O.P.
Moscou 2012
« Disposition des coefficients dans les équations chimiques »
L'enseignant, étant le personnage principal dans l'organisation de l'activité cognitive des élèves, est constamment à la recherche de moyens d'améliorer l'efficacité de l'apprentissage. L'organisation d'un enseignement efficace n'est possible qu'avec la connaissance et l'utilisation habile des diverses formes du processus pédagogique.
1. Une personne moderne doit posséder non seulement une somme de connaissances et de compétences, mais également la capacité de percevoir le monde comme un tout unique, complexe et en constante évolution.
Algorithme de préparation d'un cours
choisir un sujet, définir des objectifs ;
sélection de contenu ;
identifier les moyens et les manières de développer une attitude motivationnelle positive des élèves à l’égard du travail en classe ;
spécification d'équiper la leçon du matériel visuel et didactique nécessaire ;
élaboration d'un plan de cours
Exemple de cours de chimie « Disposition des coefficients dans une équation chimique » pour les enseignants
Cible: répondez à la question : « pourquoi avez-vous besoin de placer des coefficients dans une équation chimique ? »
Tâches:
Le problème de la nécessité d'attribuer des coefficients
Algorithme de définition des coefficients
Preuve de la signification de la disposition des coefficients
Pendant les cours :
Un étudiant moderne, s’il étudie, traite les connaissances qu’il reçoit et traite avec pragmatisme. Par conséquent, le matériel fourni doit s’adapter à votre tête de manière logique et concise.
Pour y parvenir, l'enseignant doit toujours prêter attention à Pour quoi une action ou une autre doit être apprise en classe. Autrement dit, l'enseignant doit expliquer. Et puis, dans le bon sens, attends les bonnes questions sur un nouveau sujet.
Loi de conservation de la masse des substances
Le célèbre chimiste anglais R. Boyle, calcinant divers métaux dans une cornue ouverte et les pesant avant et après chauffage, découvrit que la masse des métaux devenait plus grande. Sur la base de ces expériences, il n'a pas pris en compte le rôle de l'air et a conclu à tort que la masse des substances change à la suite de réactions chimiques. R. Boyle a soutenu qu'il existe une sorte de « matière ardente » qui, lorsqu'un métal est chauffé, se combine avec le métal, augmentant ainsi sa masse.
Mg + O 2 MgO
24g 40g
M.V. Lomonosov, contrairement à R. Boyle, calcinait les métaux non pas à l'air libre, mais dans des cornues scellées et les pesait avant et après la calcination. Il a prouvé que la masse de substances avant et après la réaction reste inchangée et que lors de la calcination, une partie de l'air est ajoutée au métal. (L’oxygène n’avait pas encore été découvert à cette époque.) Il formula les résultats de ces expériences sous la forme d’une loi : « Tous les changements qui se produisent dans la nature sont des états tels que tout ce qui est retiré d’un corps s’ajoute à un autre. » Actuellement cette loi est formulée comme suit :
La masse des substances entrées dans une réaction chimique est égale à la masse des substances formées
Mg + O 2 MgO
24 g 32 g 40 g
Question : la loi n'est pas remplie (puisque les masses des substances initiales et finales ne sont pas égales).
La solution à ce problème est la disposition des coefficients (entiers indiquant le nombre de molécules) :
2Mg + O2 2MgO
48 g 32 g 80 g – les masses avant et après sont égales car le nombre d'atomes des éléments est également égal avant et après la réaction.
Ainsi, après avoir prouvé aux étudiants la nécessité d'égaliser les coefficients de masse, on peut même se passer de certains des sujets précédents : élaborer des formules de substances par valence, calculer la masse, la quantité de substance... Aussi une histoire sur le fait que la loi de conservation de la masse de matière a été « redécouverte » 20 ans plus tard par A. Lavoisier, l'ayant clarifié d'une part, mais sans prêter aucune attention à M.V. Lomonossov avec éthique, vous pouvez le laisser à auto-apprentissage sous forme de rapport par exemple.
Ainsi, pour réussir des tâches de ce type, vous devez comprendre la condition : le nombre d'atomes avant la réaction db est égal au nombre d'atomes après la réaction : résolvons ensemble :
H 2 S + 3O 2 SO 2 + 2H 2 O (on double les oxygènes à droite. On les compte à gauche)
CH 4 + 2O 2 CO 2 + 2H 2 O
Nous avons placé les coefficients dans les équations de combustion de deux gaz
Aujourd'hui, nous allons parler de la façon de placer les coefficients dans les équations chimiques. Cette question n'intéresse pas seulement les lycéens. les établissements d'enseignement, mais aussi pour les gars qui viennent tout juste de se familiariser avec les éléments de base des systèmes complexes et science intéressante. Si vous comprenez dès la première étape, les problèmes liés à la résolution des problèmes n'apparaîtront plus à l'avenir. Voyons cela dès le début.
Quelle est l'équation
Il est généralement compris comme un enregistrement conventionnel d'une réaction chimique se produisant entre des réactifs sélectionnés. Pour un tel processus, des indices, des coefficients et des formules sont utilisés.
Algorithme de compilation
Comment écrire des équations chimiques ? Des exemples de toutes interactions peuvent être écrits en résumant les connexions originales. Le signe égal indique qu'une interaction se produit entre les substances en réaction. Ensuite, la formule des produits est établie selon la valence (état d'oxydation).
Comment enregistrer une réaction
Par exemple, si vous devez écrire des équations chimiques confirmant les propriétés du méthane, choisissez les options suivantes :
- halogénation (interaction radicale avec l'élément VIIA tableau périodique D. I. Mendeleïev) ;
- combustion dans l'oxygène de l'air.
Pour le premier cas, on écrit les substances de départ à gauche et les produits résultants à droite. Après avoir vérifié le nombre d’atomes de chaque élément chimique, nous obtenons le compte rendu final du processus en cours. Lorsque le méthane brûle dans l’oxygène, un processus exothermique se produit, entraînant la formation de dioxyde de carbone et de vapeur d’eau.
Afin de définir correctement les coefficients dans les équations chimiques, la loi de conservation de la masse des substances est utilisée. Nous commençons le processus d’égalisation en déterminant le nombre d’atomes de carbone. Ensuite, nous effectuons des calculs pour l'hydrogène et seulement après cela, nous vérifions la quantité d'oxygène.
OVR
Les équations chimiques complexes peuvent être équilibrées à l’aide de la méthode de la balance électronique ou de la demi-réaction. Nous proposons une séquence d'actions conçues pour attribuer des coefficients dans les types de réactions suivants :
- décomposition;
- substitutions.

Tout d’abord, il est important d’organiser les états d’oxydation de chaque élément du composé. Lors de leur agencement, il est nécessaire de prendre en compte quelques règles :
- Pour une substance simple, il est nul.
- Dans un composé binaire, leur somme est égale à 0.
- Dans un composé de trois éléments ou plus, le premier présente une valeur positive, l'ion le plus externe - Sens négatif degré d'oxydation. L'élément central est calculé mathématiquement en tenant compte du fait que le total doit être 0.
Ensuite, sélectionnez les atomes ou ions dont l'état d'oxydation a changé. Les signes plus et moins indiquent le nombre d'électrons (reçus, donnés). Ensuite, le plus petit multiple est déterminé entre eux. En divisant le CNP par ces nombres, les nombres sont obtenus. Cet algorithme sera la réponse à la question de savoir comment placer les coefficients dans les équations chimiques.
Premier exemple
Disons que la tâche est donnée : « Disposer les coefficients de la réaction, remplir les blancs, déterminer l'agent oxydant et l'agent réducteur ». De tels exemples sont proposés aux diplômés des écoles qui ont choisi la chimie comme examen d'État unifié.
KMnO 4 + H 2 SO 4 + KBr = MnSO 4 + Br 2 +…+…

Essayons de comprendre comment placer les coefficients dans les équations chimiques proposées aux futurs ingénieurs et médecins. Après avoir organisé les états d'oxydation des éléments dans les matières premières et les produits disponibles, nous constatons que l'ion manganèse agit comme un agent oxydant et que l'ion bromure présente des propriétés réductrices.
Nous concluons que les substances manquées ne participent pas au processus redox. L'un des produits manquants est l'eau et le second sera le sulfate de potassium. Après avoir établi la balance électronique, la dernière étape consistera à définir les coefficients de l'équation.
Deuxième exemple
Donnons un autre exemple pour comprendre comment placer des coefficients dans des équations chimiques de type redox.
Supposons que l’on nous donne le schéma suivant :
P + HNO 3 = NO 2 + … + …
Le phosphore, qui par définition est une substance simple, présente des propriétés réductrices, augmentant le degré d'oxydation à +5. Par conséquent, l'une des substances manquées sera l'acide phosphorique H 3 PO 4. ORR suppose la présence d'un agent réducteur, qui sera l'azote. Il se transforme en oxyde nitrique (4), formant du NO 2

Afin de mettre des coefficients dans cette réaction, nous établirons un bilan électronique.
P 0 donne 5e = P +5
N +5 prend e = N +4
En considérant que l'acide nitrique et le monoxyde d'azote (4) doivent être précédés d'un coefficient de 5, on obtient la réaction terminée :
P + 5HNO 3 = 5NO 2 + H 2 O + H 3 PO 4
Les coefficients stéréochimiques en chimie permettent de résoudre divers problèmes de calcul.
Troisième exemple
Considérant que la disposition des coefficients pose des difficultés à de nombreux lycéens, il est nécessaire de pratiquer l'enchaînement des actions sur exemples spécifiques. Nous proposons un autre exemple de tâche dont la réalisation nécessite la connaissance de la méthodologie de disposition des coefficients dans une réaction redox.
H 2 S + HMnO 4 = S + MnO 2 +…

La particularité de la tâche proposée est qu'il est nécessaire de compléter le produit de réaction manquant et ce n'est qu'après cela que nous pouvons procéder à la définition des coefficients.
Après avoir organisé les états d’oxydation de chaque élément des composés, nous pouvons conclure que le manganèse présente des propriétés oxydantes, réduisant sa valence. La capacité réductrice de la réaction proposée est démontrée par le soufre, réduit en une substance simple. Après avoir établi le bilan électronique, il ne reste plus qu'à disposer les coefficients dans le schéma de procédé proposé. Et c'est fait.
Quatrième exemple
Une équation chimique est appelée un processus complet lorsque la loi de conservation de la masse des substances y est pleinement respectée. Comment vérifier ce modèle ? Le nombre d'atomes du même type entrés dans la réaction doit correspondre à leur nombre dans les produits de réaction. Ce n'est que dans ce cas qu'il sera possible de parler de l'utilité de l'interaction chimique enregistrée, de la possibilité de son utilisation pour effectuer des calculs et résoudre des problèmes de calcul. différents niveaux des difficultés. Voici une variante de la tâche qui consiste à placer les coefficients stéréochimiques manquants dans la réaction :
Si + …+ HF = H 2 SiF 6 + NON +…

La difficulté de la tâche réside dans le fait qu’il manque à la fois les substances de départ et les produits de réaction. Après avoir défini les états d'oxydation de tous les éléments, nous constatons que l'atome de silicium dans la tâche proposée présente des propriétés réductrices. L'azote (II) est présent parmi les produits de réaction ; l'un des composés de départ est Acide nitrique. On détermine logiquement que le produit manquant de la réaction est de l’eau. La dernière étape sera le placement des coefficients stéréochimiques résultants dans la réaction.
3Si + 4HNO 3 + 18HF = 3H 2 SiF 6 + 4NO + 8 H 2 O
Exemple de problème d'équation
Il est nécessaire de déterminer le volume d'une solution de chlorure d'hydrogène à 10 %, dont la densité est de 1,05 g/ml, nécessaire pour neutraliser complètement l'hydroxyde de calcium formé lors de l'hydrolyse de son carbure. On sait que le gaz libéré lors de l'hydrolyse occupe un volume de 8,96 litres (n.s.). Afin de faire face à la tâche, vous devez d'abord créer une équation pour le processus d'hydrolyse du carbure de calcium :
CaC 2 + 2H 2 O = Ca (OH) 2 + C 2 H 2
L'hydroxyde de calcium réagit avec le chlorure d'hydrogène, une neutralisation complète se produit :
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

Nous calculons la masse d'acide qui sera nécessaire pour ce processus. Déterminez le volume de solution de chlorure d’hydrogène. Tous les calculs du problème sont effectués en tenant compte des coefficients stéréochimiques, ce qui confirme leur importance.
Enfin
Une analyse des résultats de l'examen d'État unifié de chimie indique que les tâches liées à la définition de coefficients stéréochimiques dans des équations, à l'établissement d'une balance électronique, à la détermination d'un agent oxydant et d'un agent réducteur posent de sérieuses difficultés aux diplômés modernes. écoles secondaires. Malheureusement, le degré d'indépendance des diplômés modernes est presque minime, de sorte que les lycéens ne mettent pas en pratique les bases théoriques proposées par l'enseignant.
Parmi erreurs typiques Les écoliers commettent de nombreuses erreurs mathématiques lorsqu'ils organisent des coefficients dans des réactions de divers types. Par exemple, tout le monde ne sait pas comment trouver le plus petit commun multiple ou comment diviser et multiplier correctement des nombres. La raison de ce phénomène est la réduction du nombre d'heures allouées aux écoles d'enseignement pour étudier ce sujet. À programme de base en chimie, les enseignants n'ont pas la possibilité d'aborder avec leurs élèves les problématiques liées à la préparation de la balance électronique dans le processus redox.
Instructions
Avant de commencer la tâche elle-même, vous devez comprendre que le numéro qui est placé devant élément chimique ou la formule entière du coefficient. Et le chiffre vaut (et légèrement) l’indice. A part ça, ça :
Le coefficient s'applique à tous les symboles chimiques qui apparaissent après lui dans la formule
Le coefficient est multiplié par l'indice (ne s'additionne pas !)
Le nombre d'atomes de chaque élément des substances entrant dans la réaction doit coïncider avec le nombre d'atomes de ces éléments inclus dans les produits de réaction.
Par exemple, écrire la formule 2H2SO4 signifie 4 atomes de H (hydrogène), 2 atomes de S (soufre) et 8 atomes de O (oxygène).
1. Exemple n°1. Considérons la combustion de l'éthylène.
Lors de la combustion matière organique du monoxyde de carbone (IV) (dioxyde de carbone) et de l'eau se forment. Essayons les coefficients séquentiellement.
C2H4 + O2 => CO2 + H2O
Commençons par analyser. 2 atomes de C (carbone) sont entrés dans la réaction, mais un seul atome a été obtenu, ce qui signifie que nous en avons mis 2 devant CO2. Maintenant, leur nombre est le même.
C2H4 + O2 => 2CO2 + H2O
Regardons maintenant H (hydrogène). 4 atomes d'hydrogène sont entrés dans la réaction, mais le résultat n'était que 2 atomes, nous en avons donc mis 2 devant H2O (eau) - maintenant nous obtenons également 4
C2H4 + O2 => 2CO2+ 2H2O
Nous comptons tous les atomes d'O (oxygène) formés à la suite de la réaction (c'est-à-dire après égalité). 4 atomes dans 2CO2 et 2 atomes dans 2H2O – un total de 6 atomes. Et avant la réaction il n'y a que 2 atomes, ce qui veut dire qu'on en met 3 devant la molécule d'oxygène O2, ce qui veut dire qu'il y en a aussi 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Ainsi, le résultat est le même nombre d’atomes de chaque élément avant et après le signe égal.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Exemple n° 2. Considérons la réaction de l'aluminium avec de l'acide sulfurique dilué.
Al + H2SO4 => Al2 (SO4) 3 + H2
Nous regardons les atomes S inclus dans Al2 (SO4) 3 - il y en a 3, mais dans H2SO4 (acide sulfurique), il n'y en a que 1, nous mettons donc également 3 devant l'acide sulfurique.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Mais maintenant, il y a 6 atomes de H (hydrogène) avant la réaction, et seulement 2 après la réaction, ce qui signifie que nous en mettons également 3 devant la molécule H2 (hydrogène), de sorte qu'au total nous obtenons 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Enfin, nous regardons. Puisqu'il n'y a que 2 atomes d'aluminium dans Al2 (SO4) 3 (sulfate d'aluminium), on en met 2 devant Al (aluminium) avant la réaction.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Or, le nombre de tous les atomes avant et après la réaction est le même. Il s'est avéré qu'il n'est pas si difficile de disposer les coefficients dans des équations chimiques. Entraînez-vous simplement et tout ira bien.
N'oubliez pas que le coefficient est multiplié par l'indice et non ajouté.
Sources:
- comment les éléments réagissent
- Test sur le thème " Équations chimiques»
Pour de nombreux écoliers, écrivez des équations de réactions chimiques et placez-les correctement chances pas de tâche facile. De plus, pour une raison quelconque, la principale difficulté pour eux réside précisément dans la deuxième partie. Il semblerait que cela n'ait rien de compliqué, mais parfois les étudiants abandonnent, tombant dans une confusion totale. Mais tu dois juste te souvenir de quelques-uns règles simples, et la tâche ne posera plus de difficultés.
Instructions
Coefficient, c'est-à-dire le nombre devant la formule de la molécule substance chimique, à tous les symboles, et multiplié par chaque symbole ! C’est multiplier, pas ajouter ! Cela peut paraître incroyable, mais certains élèves additionnent deux nombres au lieu de les multiplier.
Le nombre d'atomes de chaque élément des substances de départ (c'est-à-dire situé sur le côté gauche de l'équation) doit coïncider avec le nombre d'atomes de chaque élément des produits de réaction (respectivement situé sur son côté droit).
L'équation de réaction la plus simple est :
Fe + S => FeS
Vous devez être capable non seulement d’écrire l’équation de réaction, mais aussi de la lire. Cette équation, dans sa forme la plus simple, se lit comme suit : une molécule de fer interagit avec une molécule de soufre, ce qui donne une molécule de sulfure de fer.
La chose la plus difficile dans l'écriture d'une équation de réaction est de créer des formules pour les produits de réaction, c'est-à-dire substances formées. Il n'y a ici qu'une seule règle : les formules des molécules sont construites strictement en fonction de la valence de leurs éléments constitutifs.
De plus, lors de l'élaboration des équations de réaction, il faut se rappeler la loi de conservation de la masse des substances : tous les atomes des molécules des substances de départ doivent être inclus dans les molécules des produits de réaction. Pas un seul atome ne devrait disparaître ou apparaître de manière inattendue. Par conséquent, parfois, après avoir écrit toutes les formules de l'équation de réaction, vous devez égaliser le nombre d'atomes dans chaque partie de l'équation - définir les coefficients. Voici un exemple :
C + O2 => CO2Ici, chaque élément a le même nombre d’atomes à droite et à gauche de l’équation. L'équation est prête.
Cu+O 2 => CuO
Et ici, il y a plus d’atomes d’oxygène du côté gauche de l’équation que du côté droit. Il faut obtenir autant de molécules d'oxyde de cuivre
CuO , afin qu'ils contiennent le même nombre d'atomes d'oxygène, soit 2. Par conséquent, la formuleCuO définir le coefficient 2 :Cu+O2 => 2 CuO
Or, le nombre d’atomes de cuivre n’est plus le même. Sur le côté gauche de l'équation, avant le signe du cuivre on met le coefficient 2 :
2 Cu + O2 => 2 CuO
Comptez s'il y a un nombre égal d'atomes de chaque élément sur les côtés gauche et droit de l'équation. Si oui, alors l’équation de réaction est correcte.
Encore un exemple : Al+O 2 = Al 2 Ô 3
Et voici les atomes de chaque élément différentes quantités avant et après la réaction. Nous commençons le nivellement avec du gaz - avec des molécules d'oxygène :
1) Gauche 2 atomes d'oxygène, et à droite 3. On recherche le plus petit commun multiple de ces deux nombres. Ce le plus petit nombre, qui est divisible par 2 et par 3, soit 6. Avant les formules d'oxygène et d'oxyde d'aluminiumAl 2 Ô 3 Nous définissons de tels coefficients de telle sorte que le nombre total d'atomes d'oxygène dans ces molécules soit de 6 :
Al+ 3O2= 2Al2O 3
2) On compte le nombre d'atomes d'aluminium : à gauche il y a 1 atome, et à droite il y a 2 atomes dans deux molécules, soit 4. Avant le signe en aluminium sur le côté gauche de l'équation on met le coefficient 4 :
4Al + 3O 2 => 2 Al2O3
3) Encore une fois, on compte tous les atomes avant et après la réaction : 4 atomes d’aluminium et 6 atomes d’oxygène chacun.
Tout est en ordre, l'équation de réaction est correcte. Et si la réaction se produit lorsqu'elle est chauffée, alors un signe supplémentaire est placé au-dessus de la flèche t.
Une équation de réaction chimique est un enregistrement de la progression d'une réaction chimique en utilisant formules chimiques et les coefficients.

 Entrée
Entrée