化学方程式の係数を等化する方法。 情報カード。 「化学反応方程式の係数を並べるアルゴリズム」
レッスン13「コースより」 ダミーのための化学» 化学方程式がなぜ必要なのかを考えてください。 係数を正しく配置して化学反応を均一にする方法を学びましょう。 このレッスンでは、前のレッスンで基本的な化学を理解している必要があります。 経験式と化学分析について詳しく知るために、元素分析について必ず読んでください。
酸素 O 2 中でのメタン CH 4 の燃焼反応の結果、二酸化炭素 CO 2 と水 H 2 O が生成されます。 化学方程式:
- CH 4 + O 2 → CO 2 + H 2 O (1)
化学方程式から単なる指標ではなく、より多くの情報を抽出してみましょう 製品および試薬反応。 化学方程式 (1) は不完全であるため、1 CH 4 分子あたり何個の O 2 分子が消費され、その結果何個の CO 2 および H2 O 分子が得られるかについての情報は提供されません。 しかし、対応する分子式の前に、各タイプの分子が何個反応に参加するかを示す数値係数を書き留めると、次のようになります。 完全な化学方程式反応。
化学方程式 (1) の合成を完了するには、1 つの単純なルールを覚えておく必要があります。化学反応中に新しい原子は生成されないため、方程式の左側と右側には、各タイプの原子が同じ数含まれていなければなりません。作成されたものと既存のものは破棄されません。 この規則は、この章の冒頭で説明した質量保存の法則に基づいています。
単純な化学方程式から完全な化学方程式を得るために必要です。 それでは、実際の反応方程式 (1) に移りましょう。化学方程式を、右側と左側の原子と分子を正確に見てみましょう。 この反応には、炭素 C、水素 H、酸素 O の 3 種類の原子が関与していることが簡単にわかります。化学方程式の右側と左側にある各種類の原子の数を数えて比較してみましょう。
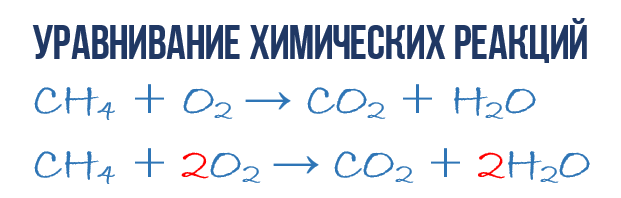
まずはカーボンから始めましょう。 左側では、1 つの C 原子が CH 4 分子の一部であり、右側では 1 つの C 原子が CO 2 の一部です。 したがって、左側と右側の炭素原子の数は同じなので、そのままにしておきます。 ただし、明確にするために、炭素を持つ分子の前に係数 1 を付けてみましょう。これは必須ではありません。
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
次に、水素原子 H の数を数えます。左側では、CH 4 分子内に 4 つの H 原子 (定量的な意味では、H 4 = 4H) があり、右側では、CH 4 分子内に 2 つの H 原子のみがあります。 H 2 O 分子。これは化学方程式 (2) の左側より 2 分の 1 です。 平等にしましょう! これを行うには、H 2 O 分子の前に係数 2 を付けてみましょう。これで、反応物と生成物の両方に 4 つの水素 H 分子が存在することになります。
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
水素 H を等しくするために水分子 H 2 O の前に書いた係数 2 は、その組成に含まれるすべての原子の 2 倍に増加することに注意してください。つまり、2H 2 O は 4H と 2O を意味します。 さて、これで問題は解決したようです。あとは化学方程式 (3) の酸素原子 O の数を数えて比較するだけです。 左側の O 原子の数が右側の 2 分の 1 であることがすぐにわかります。 これで、化学方程式のバランスを自分で計算する方法はすでにわかったので、最終結果をすぐに書き留めます。
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O または CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
ご覧のとおり、イコライゼーション 化学反応それはそれほど難しいことではなく、ここで重要なのは化学ではなく数学です。 式(4)は次のように呼ばれます。 完全な方程式化学反応は質量保存の法則に従うためです。 反応に入る各タイプの原子の数は、反応完了時のこのタイプの原子の数と正確に一致します。 この完全な化学方程式の各辺には、1 つの炭素原子、4 つの水素原子、および 4 つの酸素原子が含まれています。 ただし、いくつか理解する価値があります 重要な点: 化学反応は個々の中間段階の複雑な順序であるため、たとえば、1 つのメタン分子が 2 つの酸素分子と同時に衝突しなければならないという意味で式 (4) を解釈することは不可能です。 反応生成物の形成中に発生するプロセスははるかに複雑です。 2 番目のポイント: 完全な方程式反応は、その分子メカニズム、つまり反応が起こる間に分子レベルで起こる一連の出来事については何も教えてくれません。
化学反応方程式の係数
正しく配置する方法のもう 1 つの明確な例 オッズ化学反応方程式: トリニトロトルエン (TNT) C 7 H 5 N 3 O 6 は酸素と激しく結合して、H 2 O、CO 2 および N 2 を形成します。 等化する反応方程式を書き留めてみましょう。
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
左側には以下が含まれるため、2 つの TNT 分子に基づいて完全な方程式を作成する方が簡単です。 奇数水素原子と窒素原子、そして右側には次のものも含まれます。
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
したがって、14 個の炭素原子、10 個の水素原子、6 個の窒素原子は、14 個の二酸化炭素分子、5 個の水分子、および 3 個の窒素分子に変化する必要があることは明らかです。
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
これで、両方の部分に、酸素を除くすべての原子が同じ数含まれます。 方程式の右側に存在する 33 個の酸素原子のうち、12 個は元の 2 個の TNT 分子によって供給され、残りの 21 個は 10.5 個の O 2 分子によって供給されなければなりません。 したがって、完全な化学方程式は次のようになります。
- 2C 7 H 5 N 3 O 6 + 10.5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
両辺に 2 を乗算して、非整数係数 10.5 を取り除くことができます。
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
ただし、方程式のすべての係数が整数である必要はないため、これを行う必要はありません。 1 つの TNT 分子に基づいて方程式を作成する方がさらに正確です。
- C 7 H 5 N 3 O 6 + 5.25O 2 → 7CO 2 + 2.5H 2 O + 1.5N 2 (10)
完全な化学方程式 (9) には多くの情報が含まれています。 まず第一に、それは出発物質を示します - 試薬、 そして 製品反応。 さらに、反応中、各タイプのすべての原子が個別に保存されることがわかります。 式(9)の両辺にアボガドロ数NA = 6.022 10 23を乗算すると、4モルのTNTが21モルのO 2 と反応して28モルのCO 2 、10モルのH 2 Oおよび6モルが生成すると言えます。 N 2 のモル。
もう一つトリックがあります。 周期表を使用して、これらすべての物質の分子量を決定します。
- C 7 H 5 N 3 O 6 = 227.13 g/mol
- O2 = 31.999 g/mol
- CO2 = 44.010 g/mol
- H2O = 18.015 g/mol
- N2 = 28.013 g/mol
ここで式 9 は、反応を完了するには 4 227.13 g = 908.52 g の TNT が 21 31.999 g = 671.98 g の酸素を必要とし、その結果 28 44.010 g = 1232.3 g の CO 2 が生成され、10 · 18.015 g = 180.15 であることも示します。 g H2O および 6・28.013 g = 168.08 g N2。 この反応で質量保存則が満たされるかどうかを確認してみましょう。
| 試薬 | 製品 | |
| 908.52g TNT | 1232.3g CO2 | |
| 671.98 g CO2 | 180.15 g H2O | |
| 168.08g N2 | ||
| 合計 | 1580.5g | 1580.5g |
しかし、個々の分子が必ずしも化学反応に参加する必要はありません。 たとえば、石灰石 CaCO3 と塩酸 HCl の反応により、塩化カルシウム CaCl2 と二酸化炭素 CO2 の水溶液が生成されます。
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
化学式 (11) は、炭酸カルシウム CaCO 3 (石灰石) と塩酸 HCl が反応して、塩化カルシウム CaCl 2 と二酸化炭素 CO 2 の水溶液を生成する反応を示しています。 この方程式は、左側と右側の各種類の原子の数が同じであるため、完全です。
この方程式の意味は、 巨視的(臼歯)レベル反応を完了するには、1 モルまたは 100.09 g の CaCO 3 は 2 モルまたは 72.92 g の HCl を必要とし、結果として 1 モルの CaCl 2 (110.99 g/mol)、CO 2 (44.01 g/mol)、および H 2 が生成します。 O (18.02 g/mol)。 これらの数値データから、この反応において質量保存則が満たされていることを簡単に検証できます。
式 (11) の解釈 顕微鏡(分子)レベル炭酸カルシウムは分子化合物ではなく塩であるため、化学方程式 (11) は 1 分子の炭酸カルシウム CaCO 3 が 2 分子の HCl と反応するという意味では理解できないため、それほど明らかではありません。 さらに、溶液中の HCl 分子は通常、H + イオンと Cl - イオンに解離 (分解) します。 それでさらに 正しい説明この反応で分子レベルで何が起こるかは、次の方程式で与えられます。
- CaCO 3 (溶液) + 2H + (水溶液) → Ca 2+ (水溶液) + CO 2 (g.) + H 2 O (l.) (12)
ここでは括弧内に省略して記載します 身体的状態それぞれの種類の粒子( テレビ- 難しい、 アクア- 水溶液中の水和イオン、 G.- ガス、 そして。- 液体)。
式 (12) は、固体の CaCO 3 が 2 つの水和 H + イオンと反応し、陽イオン Ca 2+、CO 2 および H 2 O を形成することを示しています。式 (12) は、他の完全な化学方程式と同様、次の概念を与えません。分子機構が反応するため、物質の量を数えるには不便ですが、 最高の説明顕微鏡レベルで起こっていること。
自分で解決策の例に取り組むことで、化学方程式の作成に関する知識を強化します。
レッスン13からお願いします」 化学式の書き方「あなたは自分自身のために何か新しいことを学びました。 ご質問がある場合は、コメントにご記入ください。
先生がメインで 俳優生徒の認知活動を組織する際に、学習の効果を向上させる方法を常に模索しています。 効果的な教育を組織するには、さまざまな形式の教育プロセスの知識と巧みな使用が必要です。
1. 現代人知識とスキルの総和だけでなく、世界を単一の複雑で常に進化する全体として認識する能力も必要です。
ダウンロード:
プレビュー:
化学に関する記事:「化学方程式の係数の整理」
編集者:化学教師
GBOU中等学校 No.626
カズティナ O.P.
モスクワ 2012
「化学方程式の係数の整理」
教師は生徒の認知活動を組織する主人公であり、学習の効果を向上させる方法を常に模索しています。 効果的な教育を組織するには、さまざまな形式の教育プロセスの知識と巧みな使用が必要です。
1. 現代人は、知識とスキルの合計だけでなく、世界を単一の複雑で絶えず進化する全体として認識する能力も持たなければなりません。
授業の準備のためのアルゴリズム
トピックを選択し、目標を定義します。
コンテンツの選択。
教室での学習に対する生徒の前向きな意欲を育むための手段と方法を特定する。
必要な視覚的および教材をレッスンに提供するための仕様。
授業計画の作成
教師向け化学授業「化学方程式の係数の整理」の例
目標: 「なぜ化学方程式に係数を入れる必要があるのですか?」という質問に答えてください。
タスク:
係数を割り当てる必要があるという問題
係数設定アルゴリズム
係数配置の意味の証明
授業中:
現代の学生は、勉強する場合、受け取った知識を実用主義で扱い、処理します。 したがって、提供される資料は論理的かつ簡潔に頭に収まる必要があります。
これを達成するために、教師は常に次のことに注意を払う必要があります。何のために 何らかのアクションは授業で学ばなければなりません。 つまり、教師は説明しなければなりません。 そして、良い意味で、待ってください 正しい質問新しい話題について。
物質の質量保存の法則
有名な英国の化学者 R. ボイルは、オープン レトルトでさまざまな金属を焼成し、加熱の前後で重量を測定し、金属の質量が大きくなることを発見しました。 これらの実験に基づいて、彼は空気の役割を考慮しておらず、化学反応の結果として物質の質量が変化するという誤った結論を下しました。 R. ボイルは、金属が加熱されると金属と結合して質量が増加する、ある種の「燃える物質」が存在すると主張しました。
Mg + O 2 MgO
24g 40g
M.V. ロモノーソフは、R. ボイルとは異なり、屋外ではなく密閉されたレトルト内で金属を焼成し、焼成の前後で重量を測定しました。 彼は、反応の前後で物質の質量が変化しないこと、および焼成中に空気の一部が金属に追加されることを証明しました。 (当時、酸素はまだ発見されていませんでした。)彼はこれらの実験の結果を法則の形で定式化しました。「自然界で起こるすべての変化は、ある体から取り出されたものが別の体に加えられるような状態である。」 現在、この法律は次のように定式化されています。
化学反応に入った物質の質量は、形成された物質の質量に等しい
Mg + O 2 MgO
24g 32g 40g
質問: 法則は満たされません (最初の物質と最終物質の質量が等しくないため)。
この問題の解決策は、係数 (分子の数を示す整数) を配置することです。
2Mg + O2 2MgO
48 g 32 g 80 g – 元素の原子の数も反応の前後で等しいため、前後の質量は等しくなります。
したがって、質量係数を等しくする必要性を生徒に証明したので、原子価による物質の公式の作成、質量、物質の量の計算など、これまでのトピックのいくつかを省略することもできます。物質の質量保存の問題は 20 年後に A. ラヴォアジエによって「再発見」され、一方ではそれを明らかにしましたが、M.V. にはまったく注意を払っていませんでした。 ロモノーソフには倫理がある、そのままにしておいてもいい 独学たとえばレポートの形で。
したがって、この種のタスクを正常に完了するには、条件を理解する必要があります。つまり、反応データベース前の原子の数は反応後の原子の数に等しいということです。一緒に解決しましょう。
H 2 S + 3O 2 SO 2 + 2H 2 O (右側では酸素を 2 倍にします。左側では酸素を数えます)
CH 4 + 2O 2 CO 2 + 2H 2 O
2 つのガスの燃焼方程式に係数を配置しました。
今日は化学方程式に係数を配置する方法について説明します。 この質問は高校生だけではありません。 教育機関だけでなく、複雑な要素と 興味深い科学。 最初の段階で理解していれば、今後問題を解く上で問題は出てきません。 最初から考えてみましょう。
方程式とは何ですか
これは通常、選択された試薬間で起こる化学反応の従来の記録として理解されています。 このような処理には、指数、係数、式が使用されます。
コンパイルアルゴリズム
化学方程式はどうやって書くのですか? インタラクションの例は、元の接続を合計することで作成できます。 等号は、反応する物質間で相互作用が起こることを示します。 次に、価数(酸化状態)ごとに生成物の式をまとめます。
反応を記録する方法
たとえば、メタンの特性を確認する化学方程式を書き留める必要がある場合は、次のオプションを選択します。
- ハロゲン化(VIIA元素とのラジカル相互作用) 周期表 D.I.メンデレーエフ)。
- 空気中の酸素中での燃焼。
最初のケースでは、出発物質を左側に、結果として生じる生成物を右側に書きます。 各化学元素の原子数を確認した後、進行中のプロセスの最終記録を取得します。 メタンが酸素中で燃焼すると、発熱プロセスが発生し、その結果、二酸化炭素と水蒸気が形成されます。
化学方程式の係数を正しく設定するには、物質の質量保存の法則が使用されます。 均等化プロセスは、炭素原子の数を決定することから始まります。 次に、水素の計算を実行し、その後に初めて酸素の量を確認します。
OVR
複雑な化学方程式は、電子バランスまたは半反応法を使用してバランスをとることができます。 以下のタイプの反応に係数を割り当てるように設計された一連のアクションを提供します。
- 分解;
- 代替品。

まず、化合物中の各元素の酸化状態を整えることが重要です。 それらを配置するときは、いくつかのルールを考慮する必要があります。
- 単体の場合はゼロです。
- 二項複合では、それらの合計は 0 になります。
- 3 つ以上の元素の化合物では、最初の元素が正の値を示し、最も外側のイオンは - 否定的な意味酸化の程度。 中心要素は、合計が 0 でなければならないことを考慮して数学的に計算されます。
次に、酸化状態が変化した原子またはイオンを選択します。 プラス記号とマイナス記号は、電子の数 (受け取った、与えた) を示します。 次に、それらの間で最小の倍数が決定されます。 NOCをこれらの数値で割ると数値が得られます。 このアルゴリズムは、化学方程式に係数をどのように配置するかという問題に対する答えになります。
最初の例
「反応の係数を整理し、空白を埋め、酸化剤と還元剤を決定してください」という課題が与えられたとします。 このような例は、統一国家試験として化学を選択した学校卒業生に提供されます。
KMnO 4 + H 2 SO 4 + KBr = MnSO 4 + Br 2 +…+…

将来のエンジニアや医師に提供される化学方程式に係数を配置する方法を理解してみましょう。 原料や製品中の元素の酸化状態を整理すると、マンガンイオンは酸化剤として作用し、臭化物イオンは還元性を示すことが分かりました。
我々は、見逃された物質は酸化還元プロセスに関与していないと結論付けています。 不足している生成物の 1 つは水で、2 番目は硫酸カリウムになります。 電子天秤をコンパイルした後の最終段階では、方程式の係数を設定します。
2番目の例
酸化還元タイプの化学方程式に係数を配置する方法を理解するために別の例を示します。
次の図が与えられたとします。
P + HNO 3 = NO 2 + … + …
定義上、単体の物質であるリンは還元特性を示し、酸化状態を +5 まで高めます。 したがって、見逃される物質の 1 つはリン酸 H 3 PO 4 になります。ORR では、窒素である還元剤の存在が想定されます。 それは一酸化窒素 (4) に変化し、NO 2 を形成します。

この反応に係数を与えるために、電子天秤を作成します。
P 0 は 5e = P +5 を与えます
N +5 は e = N +4 を受け取ります
硝酸と一酸化窒素 (4) の前に係数 5 を付ける必要があることを考慮すると、完成した反応が得られます。
P + 5HNO 3 = 5NO 2 + H 2 O + H 3 PO 4
化学における立体化学係数を使用すると、さまざまな計算問題を解くことができます。
3番目の例
係数の配置が多くの高校生にとって難しいことを考慮すると、一連の動作を練習する必要があります。 具体的な例。 タスクの別の例を紹介します。このタスクを完了するには、酸化還元反応で係数を配置するための方法論の知識が必要です。
H 2 S + HMnO 4 = S + MnO 2 +…

提案されたタスクの特徴は、不足している反応生成物を補う必要があり、その後でのみ係数の設定に進むことができることです。
化合物中の各元素の酸化状態を整理すると、マンガンは酸化特性を示し、価数を下げると結論付けることができます。 提案された反応における還元能力は、単体に還元される硫黄によって実証されます。 電子天秤をコンパイルしたら、提案されたプロセス図に係数を配置するだけです。 そして完了です。
4番目の例
化学方程式は、その中で物質の質量保存の法則が完全に観察されるとき、完全な過程と呼ばれます。 このパターンを確認するにはどうすればよいですか? 反応に関与した同じ種類の原子の数は、反応生成物内の原子の数に対応する必要があります。 この場合にのみ、記録された化学相互作用の有用性、計算の実行および計算問題の解決への使用の可能性について話すことができます。 さまざまなレベル困難。 以下は、不足している立体化学係数を反応に配置するタスクの変形例です。
Si + …+ HF = H 2 SiF 6 + NO +…

この作業の難しさは、出発物質と反応生成物の両方が欠落していることです。 すべての元素の酸化状態を設定した後、提案されたタスクのシリコン原子が還元特性を示すことがわかります。 反応生成物中には窒素 (II) が存在します。出発化合物の 1 つは次のとおりです。 硝酸。 反応で不足している生成物は水であると論理的に判断します。 最終段階では、得られた立体化学係数を反応に配置します。
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
方程式問題の例
炭化物の加水分解中に形成される水酸化カルシウムを完全に中和するために必要な、密度が 1.05 g/ml の 10% 塩化水素溶液の体積を決定する必要があります。 加水分解中に放出されるガスの体積は 8.96 リットル (n.s.) であることが知られています。この課題に対処するには、まず炭化カルシウムの加水分解プロセスの方程式を作成する必要があります。
CaC 2 + 2H 2 O = Ca(OH) 2 + C 2 H 2
水酸化カルシウムは塩化水素と反応し、完全な中和が起こります。
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

このプロセスに必要な酸の質量を計算します。 塩化水素溶液の量を測定します。 この問題のすべての計算は立体化学係数を考慮して実行され、その重要性が確認されます。
ついに
化学の統一国家試験の結果を分析したところ、方程式の立体化学係数の設定、電子天秤の作成、酸化剤と還元剤の決定に関連する課題が現代の卒業生にとって深刻な困難を引き起こしていることが示されています。 中学校。 残念なことに、現代の卒業生の独立性の度合いはほぼ最小限であるため、高校生は教師が提案した理論的基礎を実践していません。
の間で 典型的な間違いさまざまなタイプの反応で係数を配置するときに、小学生が犯す数学的間違いは数多くあります。 たとえば、最小公倍数を見つける方法や、数値の除算と乗算を正しく行う方法を誰もが知っているわけではありません。 この現象の原因は、業務に割り当てられる時間数の減少です。 教育学校このトピックを勉強するために。 で 基本プログラム化学では、教師は酸化還元プロセスにおける電子天秤の準備に関連する問題を生徒と一緒に解決する機会がありません。
説明書
タスク自体を開始する前に、先頭に置かれている数字が 化学元素または係数式全体。 そして、この数字は指数に(そしてわずかに)価値があります。 これに加えて、次のことを行います。
この係数は、式内でその後に表示されるすべての化学記号に適用されます。
係数にインデックスが乗算されます (加算されません!)
反応に入る物質の各元素の原子の数は、反応生成物に含まれるこれらの元素の原子の数と一致しなければなりません。
たとえば、式 2H2SO4 を書くと、4 つの H (水素) 原子、2 つの S (硫黄) 原子、8 つの O (酸素) 原子を意味します。
1. 例 1. エチレンの燃焼を考えてみましょう。
燃焼時 有機物一酸化炭素 (IV) (二酸化炭素) と水が生成されます。 係数を順番に試してみましょう。
C2H4 + O2 => CO2+ H2O
分析を始めましょう。 2 個の C (炭素) 原子が反応に加わりましたが、得られた原子は 1 個だけでした。つまり、CO2 の前に 2 個を置いたことになり、その数は同じになりました。
C2H4 + O2 => 2CO2+ H2O
次に、H(水素)について見てみましょう。 4 個の水素原子が反応に加わりましたが、結果は 2 個の原子だけでした。したがって、H2O (水) の前に 2 個を置きます。今度は 4 個の原子も得られます。
C2H4 + O2 => 2CO2+ 2H2O
反応の結果として (つまり、等価の後) 形成されたすべての O (酸素) 原子を数えます。 2CO2 には 4 つの原子、2H2O には 2 つの原子、合計 6 つの原子。 そして、反応前には原子は 2 つしかありません。つまり、酸素分子 O2 の前に 3 つを置くことになります。つまり、原子も 6 つあることになります。
C2H4 + 3O2 => 2CO2+ 2H2O
したがって、結果は等号の前後で各要素の原子の数が同じになります。
C2H4 + 3O2 => 2CO2+ 2H2O
2. 例 2. アルミニウムと希硫酸の反応を考えてみましょう。
Al + H2SO4 => Al2 (SO4) 3 + H2
Al2 (SO4) 3 に含まれる S 原子に注目すると、S 原子は 3 つありますが、H2SO4 (硫酸) には 1 つだけなので、硫酸の前にも 3 を付けます。
Al + 3H2SO4 => Al2 (SO4) 3 + H2
しかし、反応前には H (水素) 原子が 6 個あり、反応後は 2 個だけになります。つまり、H2 (水素) 分子の前にも 3 個追加され、合計で 6 個になります。
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
最後に見ていきます。 Al2 (SO4) 3 (硫酸アルミニウム) にはアルミニウム原子が 2 つしかないため、反応前に Al (アルミニウム) の前に 2 を置きます。
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
これで、反応の前後ですべての原子の数は同じになります。 化学方程式の係数を整理するのはそれほど難しくないことがわかりました。 ただ練習すればすべてうまくいきます。
係数はインデックスに乗算されるものであり、加算されるものではないことに注意してください。
出典:
- 要素がどのように反応するか
- 「」というテーマでテストします 化学方程式»
多くの学童にとって、化学反応の方程式を書き、それを正しく配置する オッズ簡単な仕事ではありません。 さらに、何らかの理由で、彼らにとっての主な困難はまさにその後半部分です。 何も難しいことはないと思われますが、生徒は完全に混乱して諦めてしまうことがあります。 ただし、いくつか覚えておく必要があるだけです 簡単なルール、そしてそのタスクはもはや困難を引き起こしません。
説明書
係数、つまり分子の式の前にある数字 化学物質、すべてのシンボルに、すべてのシンボルで乗算します。 足し算ではなく、掛け算なのです! 信じられないかもしれませんが、2 つの数を掛ける代わりに足す生徒もいます。
出発物質の各元素の原子数 (つまり、方程式の左側に位置する) は、反応生成物の各元素の原子の数 (それぞれ右側に位置します) と一致する必要があります。
最も単純な反応式は次のとおりです。
Fe + S => FeS
反応式は書けるだけでなく読める必要があります。 この方程式は、最も単純な形では次のようになります。鉄分子が硫黄分子と相互作用し、結果として 1 分子の硫化鉄が生成されます。
反応方程式を書く際に最も難しいのは、反応生成物の式を作成することです。 形成された物質。 ここでのルールは 1 つだけです。分子の式は構成要素の価数に厳密に従って構築されるということです。
さらに、反応方程式を作成するときは、物質の質量保存の法則を覚えておく必要があります。つまり、出発物質の分子のすべての原子が反応生成物の分子に含まれていなければなりません。 原子が 1 つも消えたり、予期せず現れたりしてはなりません。 したがって、場合によっては、反応方程式にすべての式を記述した後、方程式の各部分の原子の数を均等にし、係数を設定する必要があります。 以下に例を示します。
C + O 2 => CO 2ここで、各要素は方程式の右側と左側の両方に同じ数の原子を持ちます。 方程式が完成しました。
Cu+O 2 => CuO
そしてここでは、方程式の右側よりも左側の方が酸素原子の数が多くなります。 非常に多くの酸化銅分子を得る必要がある
CuO , 同じ数、つまり 2 個の酸素原子が含まれるようにします。 したがって、式はCuO 係数 2 を設定します:Cu+O2 => 2CuO
さて、銅原子の数は同じではありません。 方程式の左側、銅記号の前に係数 2 を入れます。
2Cu+O2 => 2CuO
方程式の左側と右側にある各要素の原子の数が等しいかどうかを数えます。 「はい」の場合、反応式は正しいことになります。
もう 1 つの例: Al+O 2 = アル 2 ○ 3
そして、これが各元素の原子です 異なる量反応前と反応後。 ガス、つまり酸素分子を使ってレベリングを開始します。
1つ残り 酸素原子が 2 つ、右側が 3 つです。 これら 2 つの数値の最小公倍数を探します。 これ 最小の数、これは 2 と 3 の両方で割り切れます、つまり 6 です。 酸素と酸化アルミニウムの式の前アル 2 ○ 3 これらの分子内の酸素原子の総数が 6 になるように係数を設定します。
アル+ 3O2= 2Al2O 3
2) アルミニウム原子の数を数えます。左側には 2 つの分子に 1 つの原子があり、右側には 2 つの原子、つまり 4 つの原子があります。 方程式の左側のアルミニウム記号の前に係数 4 を置きます。
4Al+3O 2 => 2 Al2O3
3) もう一度、反応の前後ですべての原子を数えます。アルミニウム原子が 4 個、酸素原子が 6 個ずつです。
すべてが順調で、反応方程式は正しいです。 加熱時に反応が起こる場合は、矢印の上に追加の記号が表示されます。 t.
化学反応方程式とは、化学反応の進行を記録したものです。 化学式そして係数。

 入り口
入り口