ترتیب ضرایب در معادلات شیمیایی. کارت اطلاعات. "الگوریتم ترتیب ضرایب در معادلات واکنش شیمیایی."
ساده ترین معادله واکنش:
Fe + S => FeS
شما باید بتوانید نه تنها معادله واکنش را بنویسید، بلکه آن را نیز بخوانید. این معادله در سادهترین شکل خود به این صورت است: یک مولکول آهن با یک مولکول گوگرد برهمکنش میکند و در نتیجه یک مولکول سولفید آهن به وجود میآید.
دشوارترین کار در نوشتن یک معادله واکنش، ایجاد فرمول برای محصولات واکنش است. مواد تشکیل شده است. در اینجا فقط یک قانون وجود دارد: فرمول های مولکول ها دقیقاً بر اساس ظرفیت عناصر تشکیل دهنده آنها ساخته می شوند.
علاوه بر این، هنگام ترسیم معادلات واکنش، باید قانون بقای جرم مواد را به خاطر بسپارید: تمام اتم های مولکول های مواد اولیه باید در مولکول های محصولات واکنش گنجانده شوند. حتی یک اتم نباید ناپدید شود یا به طور غیر منتظره ظاهر شود. بنابراین، گاهی اوقات، با نوشتن تمام فرمول ها در معادله واکنش، باید تعداد اتم ها را در هر قسمت از معادله برابر کنید - ضرایب را تنظیم کنید. در اینجا یک مثال است:
C + O 2 => CO 2در اینجا، هر عنصر دارای تعداد یکسانی اتم در دو سمت راست و چپ معادله است. معادله آماده است.
Cu+O 2 => CuO
و در اینجا اتم های اکسیژن در سمت چپ معادله بیشتر از سمت راست وجود دارد. به دست آوردن مولکول های زیادی از اکسید مس ضروری است
CuO , به طوری که آنها حاوی همان تعداد اتم اکسیژن هستند، یعنی 2. بنابراین، فرمولCuO مجموعه ضریب 2:Cu+O2 => 2 CuO
حالا تعداد اتم های مس یکسان نیست. در سمت چپ معادله، قبل از علامت مس، ضریب 2 را قرار می دهیم:
2 مس + O2 => 2 CuO
شمارش کنید که آیا تعداد اتم های هر عنصر در سمت چپ و راست معادله برابر است یا خیر. اگر بله، پس معادله واکنش صحیح است.
یک مثال دیگر: Al+O 2 = ال 2 O 3
و در اینجا اتم های هر عنصر وجود دارد مقادیر مختلفقبل و بعد از واکنش ما شروع به تراز کردن با گاز - با مولکول های اکسیژن می کنیم:
1) سمت چپ 2 اتم اکسیژن و در سمت راست 3 اتم است. ما به دنبال حداقل مضرب مشترک این دو عدد هستیم. این کوچکترین عددکه بر 2 و 3 یعنی 6 بخش پذیر است. قبل از فرمول های اکسیژن و اکسید آلومینیومال 2 O 3 ما چنین ضرایبی را طوری تنظیم می کنیم که تعداد کل اتم های اکسیژن در این مولکول ها 6 باشد:
Al+ 3 O 2= 2 Al 2 O 3
2) تعداد اتم های آلومینیوم را می شماریم: در سمت چپ 1 اتم و در سمت راست 2 اتم در دو مولکول، یعنی 4 وجود دارد. قبل از علامت آلومینیوم در سمت چپ معادله، ضریب 4 را قرار می دهیم:
4Al + 3O 2 => 2 Al2O3
3) یک بار دیگر تمام اتم ها را قبل و بعد از واکنش می شماریم: هر کدام 4 اتم آلومینیوم و 6 اتم اکسیژن.
همه چیز مرتب است، معادله واکنش درست است. و اگر واکنش هنگام گرم شدن رخ دهد، علامت اضافی بالای فلش قرار می گیردتی
معادله یک واکنش شیمیایی ثبت پیشرفت یک واکنش شیمیایی با استفاده از فرمول ها و ضرایب شیمیایی است.
محدوده ضرایب
تعداد اتم های یک عنصر در سمت چپ معادله باید با تعداد اتم های آن عنصر در سمت راست معادله برابر باشد.
وظیفه 1 (برای گروه ها).تعداد اتم های هر کدام را مشخص کنید عنصر شیمیاییدرگیر واکنش است.
1- تعداد اتم ها را محاسبه کنید:
الف) هیدروژن: 8NH3، NaOH، 6NaOH، 2NaOH، H3PO4، 2H2SO4، 3H2S04، 8H2SO4.
6) اکسیژن: C02، 3C02، 2C02، 6CO، H2SO4، 5H2SO4، 4H2S04، HN03.
2. تعداد اتم ها را محاسبه کنید: الف)هیدروژن:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
ب) اکسیژن:
1) 2СО + 02 2) С02 + 2Н.О. 3) 4NO2 + 2H2O + O2
الگوریتم قرار دادن ضرایب در معادلات واکنش های شیمیایی
А1 + О2→ А12О3اتم A1-1 A1-2
اتم O-2 O-3
2. در میان عناصر با اعداد مختلفاتم های سمت چپ و راست نمودار، اتم هایی را انتخاب کنید که تعداد اتم های آن بیشتر باشد
اتم های O-2 در سمت چپ
اتم های O-3 در سمت راست
3. حداقل مضرب مشترک (LCM) تعداد اتم های این عنصر را در سمت چپ معادله و تعداد اتم های این عنصر را در سمت راست معادله بیابید.
LCM = 6
4. LCM را بر تعداد اتم های این عنصر در سمت چپ معادله تقسیم کنید، ضریب سمت چپ معادله را به دست آورید.
6:2 = 3
Al + ZO 2 → آل 2 در باره 3
5. LCM را بر تعداد اتم های این عنصر در سمت راست معادله تقسیم کنید، ضریب سمت راست معادله را بدست آورید.
6:3 = 2
A1+ O 2 → 2A1 2 O3
6. اگر ضریب مجموعه تعداد اتم های عنصر دیگری را تغییر داده است، مراحل 3، 4، 5 را دوباره تکرار کنید.
A1 + ZO 2 → → 2A1 2 در باره 3
A1 -1 اتم A1 - 4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → → 2A1 2 در باره 3
. آزمون اولیه کسب دانش (8-10 دقیقه .).
دو اتم اکسیژن در سمت چپ نمودار و یک اتم در سمت راست وجود دارد. تعداد اتم ها باید با استفاده از ضرایب برابر شود.
1) 2Mg+O2 → 2MgO
2) CaCO3 + 2HCl→CaCl2 + ن2 O + CO2
وظیفه 2 ضرایب را در معادلات واکنش های شیمیایی قرار دهید (توجه داشته باشید که ضریب تعداد اتم های یک عنصر را تغییر می دهد.):
1. Fe 2 O 3 + A ل → آ ل 2 در باره 3 + آهن؛ Mg+N 2 → Mg 3 ن 2 ;
2. Al + S → ال 2 اس 3 ; A1+ با → ال 4 سی 3 ;
3. Al + Cr 2 O 3 → Cr+Al 2 O 3 ; Ca+P → حدود 3 پ 2 ;
4. C + اچ 2 → CH 4 ; حدود + سی → SaS 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si+Mg → Mg 2 Si;
6/.Na+S → Na 2 S; CaO+ با → CaC 2 + CO؛
7. Ca+N 2 → سی آ 3 ن 2 ; Si+Cl 2 → SiCl 4 ;
8. Ag+S → Ag 2 S; ن 2 + با ل 2 → NS ل
9.N 2 + O 2 → نه CO 2 + با → CO ;
10. سلام → ن 2 → + 1 2 ; Mg+ NS ل → MgCl 2 + ن 2 ;
11. FeS+ NS 1 → FeCl 2 +H 2 S; روی + هیدروکلراید → ZnCl 2 +H 2 ;
12. برادر 2 +KI → KBr+ I 2 ; Si + HF (ر) → SiF 4 +H 2 ;
1./HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+ SO 2 ;
14. کل 2 + KBr → KCl + Br 2 ; SiO 2 + با → Si + CO;
15. SiO 2 + با → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16 .
3. علامت + در یک معادله به چه معناست؟
4. چرا ضرایب در معادلات شیمیایی قرار می گیرند؟
1. بیایید یک نمودار واکنش ترسیم کنیم:
اهداف درسآموزشی.دانش آموزان را با طبقه بندی جدیدی از واکنش های شیمیایی بر اساس تغییرات در حالت های اکسیداسیون عناصر - واکنش های اکسیداسیون-کاهش (ORR) آشنا کنید. ترتیب ضرایب را با استفاده از روش تراز الکترونیکی به دانش آموزان آموزش دهید.
رشدی.توسعه را ادامه دهید تفکر منطقی، مهارت های تجزیه و تحلیل و مقایسه، ایجاد علاقه به موضوع.
آموزشی.شکل گیری جهان بینی علمی دانشجویان؛ بهبود مهارت های کاری
روش ها و تکنیک های روش شناختی.داستان، گفتگو، نمایش وسایل کمک بصری، کار مستقلدانش آموزان.
تجهیزات و معرف ها.تولید مثل با تصویر کلوسوس رودز، الگوریتم ترتیب ضرایب با استفاده از روش تعادل الکترونیکی، جدول عوامل اکسید کننده و کاهنده معمولی، جدول کلمات متقاطع. آهن (ناخن)، محلول های NaOH، CuSO4.
در طول کلاس ها
بخش مقدماتی
(انگیزه و هدف گذاری)
معلم. در قرن 3. قبل از میلاد مسیح. در جزیره رودس، بنای یادبودی به شکل مجسمه عظیم هلیوس (خدای یونانی خورشید) ساخته شد. طراحی باشکوه و اجرای عالی کلوسوس رودز - یکی از عجایب جهان - همه کسانی را که آن را دیدند شگفت زده کرد.
ما دقیقاً نمی دانیم که مجسمه چه شکلی است، اما می دانیم که از برنز ساخته شده بود و ارتفاع آن به حدود 33 متر می رسید. مجسمه توسط مجسمه ساز هارت ساخته شد و ساخت آن 12 سال طول کشید.
پوسته برنزی به یک قاب آهنی متصل شده بود. مجسمه توخالی از پایین شروع به ساختن کرد و همانطور که رشد کرد، برای پایدارتر کردن آن با سنگ پر شد. حدود 50 سال پس از اتمام آن، کلوسوس سقوط کرد. در هنگام زلزله در سطح زانو شکست.
دانشمندان معتقدند که دلیل واقعیشکنندگی این معجزه به دلیل خوردگی فلز بود. و فرآیند خوردگی بر اساس واکنش های ردوکس است.
امروز در درس با واکنش های ردوکس آشنا خواهید شد. در مورد مفاهیم "عامل کاهنده" و "عامل اکسید کننده"، در مورد فرآیندهای کاهش و اکسیداسیون بیاموزید. یاد بگیرید که ضرایب را در معادلات واکنش های ردوکس قرار دهید. تاریخ و موضوع درس را در کتاب کار خود یادداشت کنید.
یادگیری مطالب جدید
معلم دو آزمایش نمایشی انجام می دهد: برهمکنش سولفات مس (II) با قلیایی و برهم کنش همان نمک با آهن.
معلم. معادلات مولکولی واکنش های انجام شده را بنویسید. در هر معادله، حالت های اکسیداسیون عناصر را در فرمول مواد اولیه و محصولات واکنش ترتیب دهید.
دانش آموز معادلات واکنش را روی تخته می نویسد و حالت های اکسیداسیون را تعیین می کند:
معلم. آیا حالت اکسیداسیون عناصر در این واکنش ها تغییر کرد؟
دانشجو. در معادله اول، حالت های اکسیداسیون عناصر تغییر نکرد، اما در رابطه دوم آنها تغییر کردند - برای مس و آهن..
معلم. واکنش دوم یک واکنش ردوکس است. سعی کنید واکنش های ردوکس را تعریف کنید.
دانشجو. واکنش هایی که منجر به تغییر در حالت اکسیداسیون عناصر تشکیل دهنده واکنش دهنده ها و محصولات واکنش می شوند، واکنش های ردوکس نامیده می شوند.
دانشآموزان در دفترچههای خود، به دستور معلم، تعریف واکنشهای ردوکس را یادداشت میکنند.
معلم. در نتیجه واکنش ردوکس چه اتفاقی افتاد؟ قبل از واکنش، آهن حالت اکسیداسیون 0 داشت و پس از واکنش 2+ شد. همانطور که می بینیم، حالت اکسیداسیون افزایش یافته است، بنابراین، آهن 2 الکترون می دهد.
حالت اکسیداسیون مس قبل از واکنش 2 + و بعد از واکنش 0 است و همانطور که می بینیم حالت اکسیداسیون کاهش یافته است. بنابراین مس 2 الکترون می پذیرد.
آهن الکترون اهدا می کند، یک عامل کاهنده است و فرآیند انتقال الکترون را اکسیداسیون می نامند.
مس الکترون ها را می پذیرد، یک عامل اکسید کننده است و فرآیند افزودن الکترون ها را کاهش می گویند.
اجازه دهید نمودارهای این فرآیندها را بنویسیم:
بنابراین، تعریفی از مفاهیم "عامل کاهنده" و "عامل اکسید کننده" ارائه دهید.
دانشجو. اتم ها، مولکول ها یا یون هایی که الکترون اهدا می کنند، عوامل کاهنده نامیده می شوند.
اتم ها، مولکول ها یا یون هایی که الکترون به دست می آورند، عوامل اکسید کننده نامیده می شوند.
معلم. چگونه می توانیم فرآیندهای احیا و اکسیداسیون را تعریف کنیم؟
دانشجو. کاهش فرآیندی است که طی آن یک اتم، مولکول یا یون الکترون به دست می آورد.
اکسیداسیون فرآیند انتقال الکترون توسط یک اتم، مولکول یا یون است.
دانش آموزان تعاریف دیکته را در دفتر یادداشت کرده و نقاشی می کنند.
یاد آوردن!
الکترون اهدا کنید و اکسید کنید.
الکترون بگیرید - بازیابی کنید.
معلم. اکسیداسیون همیشه با کاهش همراه است و برعکس، کاهش همیشه با اکسیداسیون همراه است. تعداد الکترون هایی که عامل احیا کننده می دهد برابر است با تعداد الکترون های بدست آمده توسط عامل اکسید کننده.
برای انتخاب ضرایب در معادلات واکنش های ردوکس، از دو روش استفاده می شود - تعادل الکترونیکی و تعادل الکترون یون (روش نیمه واکنش).
ما فقط روش تراز الکترونیکی را در نظر خواهیم گرفت. برای این کار از الگوریتمی برای چیدمان ضرایب به روش تراز الکترونیکی (طراحی شده بر روی یک تکه کاغذ واتمن) استفاده می کنیم.
مثال ضرایب را در این طرح واکنش با استفاده از روش تعادل الکترونیکی ترتیب دهید، عامل اکسید کننده و عامل احیا کننده را تعیین کنید، فرآیندهای اکسیداسیون و کاهش را نشان دهید:
Fe2O3 + CO Fe + CO2.
از الگوریتم ترتیب ضرایب با استفاده از روش تراز الکترونیکی استفاده خواهیم کرد.
3. بیایید عناصری را که حالت اکسیداسیون را تغییر می دهند بنویسیم:
4. بیایید معادلات الکترونیکی ایجاد کنیم و تعداد الکترون های داده شده و دریافتی را تعیین کنیم:
5. تعداد الکترون های داده شده و دریافتی باید یکسان باشد، زیرا نه مواد اولیه و نه محصولات واکنش شارژ نمی شوند. تعداد الکترون های داده شده و دریافتی را با انتخاب کمترین مضرب مشترک (LCM) و عوامل اضافی برابر می کنیم:
6. ضرب کننده های حاصل ضرایب هستند. بیایید ضرایب را به طرح واکنش منتقل کنیم:
Fe2O3 + 3CO = 2Fe + 3CO2.
موادی که در بسیاری از واکنش ها عامل اکسید کننده یا کاهنده هستند، معمولی نامیده می شوند.
میزی ساخته شده بر روی یک تکه کاغذ واتمن آویزان شده است.
معلم. واکنش های ردوکس بسیار رایج هستند. آنها نه تنها با فرآیندهای خوردگی، بلکه با تخمیر، پوسیدگی، فتوسنتز و فرآیندهای متابولیکی که در یک موجود زنده رخ می دهد نیز مرتبط هستند. آنها را می توان در هنگام احتراق سوخت مشاهده کرد.
چگونه یک معادله شیمیایی را متعادل کنیم: قوانین و الگوریتم
فرآیندهای ردوکس با چرخه مواد در طبیعت همراه است.
آیا می دانستید که روزانه تقریباً 2 میلیون تن اسید نیتریک در جو تشکیل می شود
700 میلیون تن در سال و به صورت محلول ضعیف همراه با باران به زمین می ریزد (انسان فقط 30 میلیون تن اسید نیتریک در سال تولید می کند).
در جو چه می گذرد؟
هوا دارای 78 درصد حجمی نیتروژن، 21 درصد اکسیژن و 1 درصد گازهای دیگر است. تحت تأثیر تخلیه رعد و برق، و بر روی زمین به طور متوسط 100 رعد و برق در هر ثانیه وجود دارد، مولکول های نیتروژن با مولکول های اکسیژن تعامل می کنند و اکسید نیتریک (II) را تشکیل می دهند:
اکسید نیتریک (II) به راحتی توسط اکسیژن اتمسفر به اکسید نیتریک (IV) اکسید می شود:
اکسید نیتروژن حاصله (IV) با رطوبت اتمسفر در حضور اکسیژن واکنش داده و به اسید نیتریک تبدیل می شود:
NO2 + H2O + O2 HNO3.
همه این واکنش ها ردوکس هستند.
ورزش . ضرایب را در طرح های واکنش داده شده با استفاده از روش تعادل الکترونیکی ترتیب دهید، عامل اکسید کننده، عامل کاهنده، فرآیندهای اکسیداسیون و احیا را نشان دهید.
راه حل
1. حالات اکسیداسیون عناصر را تعیین می کنیم:
2. اجازه دهید بر نمادهای عناصری که حالت اکسیداسیون آنها تغییر می کند تأکید کنیم:
3. بیایید عناصری را که حالت اکسیداسیون خود را تغییر داده اند بنویسیم:
4. بیایید معادلات الکترونیکی ایجاد کنیم (تعداد الکترون های داده شده و دریافتی را تعیین کنیم):
5. تعداد الکترون های داده شده و دریافتی یکسان است.
6. ضرایب را از مدارهای الکترونیکیدر طرح واکنش:
در مرحله بعد، از دانش آموزان خواسته می شود که به طور مستقل ضرایب را با استفاده از روش تعادل الکترونیکی ترتیب دهند، عامل اکسید کننده، عامل کاهنده را تعیین کنند و فرآیندهای اکسیداسیون و کاهش را در سایر فرآیندهای رخ داده در طبیعت نشان دهند.
دو معادله دیگر واکنش (با ضرایب) به شکل زیر است:
صحت کارها با استفاده از یک پروژکتور سربار بررسی می شود.
قسمت پایانی
معلم از دانش آموزان می خواهد که بر اساس مطالبی که مطالعه کرده اند، جدول کلمات متقاطع را حل کنند. نتیجه کار برای تایید ارسال می شود.
حل شده است جدول کلمات متقاطع، خواهید آموخت که مواد KMnO4، K2Cr2O7، O3 قوی هستند... (عمودی (2)).
به صورت افقی:
1. نمودار چه فرآیندی را منعکس می کند:
3. واکنش
N2 (گرم) + 3H2 (گرم) 2NH3 (گرم) + س
ردوکس است، برگشت پذیر، همگن، ....
4. ... کربن (II) یک عامل کاهنده معمولی است.
5. نمودار چه فرآیندی را منعکس می کند:
6. برای انتخاب ضرایب در معادلات واکنش های ردوکس از روش... الکترونیکی استفاده کنید.
7. طبق نمودار، آلومینیوم از یک الکترون جدا شد.
8. در واکنش:
Н2 + Сl2 = 2НCl
هیدروژن H2 – ... .
9. چه نوع واکنش هایی همیشه فقط ردوکس هستند؟
10. حالت اکسیداسیون مواد ساده ….
11. در واکنش:
عامل کاهنده -….
تکلیف خانه.
طبق کتاب درسی O.S. Gabrielyan "شیمی-8" § 43، ص. 178-179، پیشین. 1، 7 به صورت مکتوب. وظیفه (برای خانه). طراحان اولین سفینه های فضاییو زیردریایی ها با مشکل مواجه شدند: نحوه حفظ ترکیب هوای ثابت در کشتی و ایستگاه های فضایی? از شر دی اکسید کربن اضافی خلاص شوید و اکسیژن را دوباره پر کنید؟ راه حلی پیدا شده است.
سوپراکسید پتاسیم KO2 با دی اکسید کربن واکنش داده و اکسیژن تشکیل می دهد:
همانطور که می بینید، این یک واکنش ردوکس است. اکسیژن در این واکنش هم عامل اکسید کننده و هم عامل کاهنده است.
در یک ماموریت فضایی، هر گرم محموله مهم است. اگر پرواز 10 روز طول بکشد و خدمه آن دو نفر باشند، مقدار سوپراکسید پتاسیمی که باید در یک پرواز فضایی گرفته شود را محاسبه کنید. مشخص است که یک فرد روزانه 1 کیلوگرم دی اکسید کربن را بازدم می کند.
(پاسخ: 64.5 کیلوگرم KO2. )
ورزش ( افزایش سطحمشکلات). معادلات واکنشهای ردوکس را که میتواند منجر به نابودی کلوسوس رودز شود، بنویسید. به خاطر داشته باشید که این مجسمه غول پیکر در شهری بندری در جزیره ای در دریای اژه، در سواحل ترکیه امروزی، جایی که هوای مرطوب مدیترانه مملو از نمک است، ایستاده است. از برنز (آلیاژی از مس و قلع) ساخته شده بود و بر روی قاب آهنی نصب می شد.
ادبیات
گابریلیان او.اس.. شیمی-8. M.: Bustard، 2002;
Gabrielyan O.S.، Voskoboynikova N.P.، Yashukova A.V.کتاب راهنمای معلم. کلاس هشتم. M.: Bustard، 2002;
کاکس آر، موریس ان. عجایب هفت گانه جهان. دنیای باستان، قرون وسطی، زمان ما. M.: BMM AO، 1997;
دایره المعارف کودکان کوچک. علم شیمی. م.: مشارکت دایره المعارفی روسیه، 2001; دایره المعارف برای کودکان "آوانتا+". علم شیمی. T. 17. M.: آوانتا+، 2001;
Khomchenko G.P.، Sevastyanova K.I.واکنش های ردوکس م.: آموزش و پرورش، 1989.
اس پی لبشوا،
معلم شیمی دبیرستان شماره 8
(بالتیسک، منطقه کالینینگراد)
قوانین انتخاب شانس:
- اگر تعداد اتم های یک عنصر در یک قسمت از طرح واکنش زوج و در قسمت دیگر فرد باشد، باید ضریب 2 در مقابل فرمول با تعداد فرد اتم ها و سپس تعداد همه اتم ها قرار داده شود. اتم ها باید یکسان شوند.
- قرار دادن ضرایب باید با پیچیده ترین ماده در ترکیب شروع شود و این کار را به ترتیب زیر انجام دهید:
ابتدا باید تعداد اتم های فلز را برابر کنید، سپس - باقی مانده های اسید (اتم های غیر فلزی)، سپس اتم های هیدروژن، و در آخر - اتم های اکسیژن.
- اگر تعداد اتم های اکسیژن در سمت چپ و راست معادله یکسان باشد، ضرایب به درستی تعیین می شوند.
- پس از این، فلش بین قسمت های معادله را می توان با علامت مساوی جایگزین کرد.
- ضرایب در معادله واکنش شیمیایی نباید مقسوم علیه مشترک داشته باشند.
مثال. بیایید یک معادله برای واکنش شیمیایی بین هیدروکسید آهن (III) و اسید سولفوریک برای تشکیل سولفات آهن (III) ایجاد کنیم.
1. بیایید یک نمودار واکنش ترسیم کنیم:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2. برای فرمول مواد ضرایبی را انتخاب می کنیم. می دانیم که باید با پیچیده ترین ماده شروع کنیم و به طور متوالی در کل طرح یکسان کنیم، ابتدا اتم های فلز، سپس باقی مانده های اسید، سپس هیدروژن و در نهایت اکسیژن. در طرح ما، پیچیده ترین ماده Fe2(SO4)3 است. حاوی دو اتم آهن و Fe(OH)3 دارای یک اتم آهن است. این بدان معنی است که قبل از فرمول Fe(OH)3 باید ضریب 2 قرار دهید:
2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
حالا بیایید تعداد باقی مانده های اسیدی SO4 را برابر کنیم. نمک Fe2(SO4)3 حاوی سه باقیمانده SO4 اسیدی است. یعنی در سمت چپ قبل از فرمول H2SO4 ضریب 3 قرار می دهیم:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O.
حالا بیایید تعداد اتم های هیدروژن را برابر کنیم. در سمت چپ نمودار در هیدروکسید آهن 2Fe(OH)3 – 6 اتم هیدروژن (2
· 3)، در اسید سولفوریک 3H2SO4 نیز 6 اتم هیدروژن وجود دارد.
نحوه قرار دادن ضرایب در معادلات شیمیایی
در کل 12 اتم هیدروژن در سمت چپ وجود دارد. این بدان معنی است که در سمت راست ما ضریب 6 را در مقابل فرمول آب H2O قرار می دهیم - و اکنون نیز 12 اتم هیدروژن در سمت راست وجود دارد:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
باقی مانده است که تعداد اتم های اکسیژن برابر شود. اما این دیگر ضروری نیست، زیرا قسمت های چپ و راست نمودار از قبل دارای همان تعداد اتم اکسیژن هستند - 18 در هر قسمت. این به این معنی است که نمودار به طور کامل نوشته شده است و می توانیم فلش را با علامت مساوی جایگزین کنیم:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O.
تحصیلات
چگونه ضرایب را در معادلات شیمیایی قرار دهیم؟ معادلات شیمیایی
امروز در مورد نحوه تعیین شانس صحبت خواهیم کرد معادلات شیمیایی. این سوال نه تنها برای دانش آموزان دبیرستانی جالب است. موسسات آموزشی، بلکه برای پسرانی که به تازگی با عناصر اولیه پیچیده و علم جالب. اگر در مرحله اول نحوه نوشتن معادلات شیمیایی را بدانید، در آینده برای حل مسائل مشکلی نخواهید داشت. بیایید از همان ابتدا آن را بفهمیم.
معادله چیست
معمولاً به عنوان یک ثبت مرسوم از یک واکنش شیمیایی که بین معرف های انتخاب شده رخ می دهد درک می شود. برای چنین فرآیندی از شاخص ها، ضرایب و فرمول ها استفاده می شود.
الگوریتم کامپایل
چگونه معادلات شیمیایی بنویسیم؟ نمونههایی از هر گونه تعامل را میتوان با خلاصه کردن اتصالات اصلی نوشت. علامت مساوی نشان می دهد که برهمکنش بین مواد واکنش دهنده رخ می دهد. سپس فرمول محصولات بر اساس ظرفیت (وضعیت اکسیداسیون) تهیه می شود.
ویدیو در مورد موضوع
نحوه ثبت واکنش
به عنوان مثال، اگر نیاز به نوشتن معادلات شیمیایی تایید کننده خواص متان دارید، گزینه های زیر را انتخاب کنید:
- هالوژناسیون (برهمکنش رادیکال با عنصر VIIA جدول تناوبی D. I. مندلیف)؛
- احتراق در اکسیژن هوا

برای مورد اول، مواد اولیه را در سمت چپ و محصولات حاصل را در سمت راست می نویسیم. پس از بررسی تعداد اتم های هر عنصر شیمیایی، رکورد نهایی فرآیند در حال انجام را به دست می آوریم. هنگامی که متان در اکسیژن می سوزد، یک فرآیند گرمازا رخ می دهد که منجر به تشکیل دی اکسید کربن و بخار آب می شود.
برای تنظیم صحیح ضرایب در معادلات شیمیایی از قانون بقای جرم مواد استفاده می شود. فرآیند یکسان سازی را با تعیین تعداد اتم های کربن آغاز می کنیم. در مرحله بعد، ما محاسبات هیدروژن را انجام می دهیم و تنها پس از آن مقدار اکسیژن را بررسی می کنیم.
OVR
معادلات پیچیده شیمیایی را می توان با استفاده از موازنه الکترون یا روش نیمه واکنش متعادل کرد. ما دنباله ای از اقدامات طراحی شده برای تخصیص ضرایب در انواع واکنش های زیر را ارائه می دهیم:

اول، مهم است که حالت های اکسیداسیون هر عنصر در ترکیب را ترتیب دهیم. هنگام تنظیم آنها، لازم است برخی از قوانین را در نظر بگیرید:
- برای یک ماده ساده صفر است.
- در یک ترکیب باینری مجموع آنها 0 است.
- در ترکیبی از سه یا چند عنصر، اولی یک مقدار مثبت نشان می دهد، بیرونی ترین یون - معنی منفیدرجه اکسیداسیون عنصر مرکزی به صورت ریاضی محاسبه می شود، با در نظر گرفتن اینکه کل باید 0 باشد.
سپس آن اتم ها یا یون هایی را انتخاب کنید که حالت اکسیداسیون آنها تغییر کرده است. علامت مثبت و منفی تعداد الکترون ها (دریافت شده، داده شده) را نشان می دهد. سپس کوچکترین مضرب بین آنها تعیین می شود. هنگام تقسیم NOC بر این اعداد، اعداد به دست می آیند. این الگوریتم پاسخی به این سوال خواهد بود که چگونه ضرایب را در معادلات شیمیایی قرار دهیم.
مثال اول
فرض کنید این کار داده شده است: "ضرایب در واکنش را مرتب کنید، جاهای خالی را پر کنید، عامل اکسید کننده و عامل کاهنده را تعیین کنید." چنین نمونه هایی برای فارغ التحصیلان مدرسه ای ارائه می شود که شیمی را به عنوان آزمون دولتی واحد خود انتخاب کرده اند.
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 +…+…

بیایید سعی کنیم نحوه قرار دادن ضرایب در معادلات شیمیایی ارائه شده به مهندسان و پزشکان آینده را درک کنیم. پس از مرتب کردن حالتهای اکسیداسیون عناصر در مواد اولیه و محصولات موجود، متوجه میشویم که یون منگنز به عنوان یک عامل اکسید کننده عمل میکند و یون برمید خواص کاهشی از خود نشان میدهد.
نتیجه می گیریم که مواد از دست رفته در فرآیند ردوکس شرکت نمی کنند. یکی از محصولات گم شده آب است و دومی سولفات پتاسیم است. پس از تدوین تراز الکترونیکی، مرحله نهایی تعیین ضرایب در معادله خواهد بود.
مثال دوم
بیایید مثال دیگری بزنیم تا بفهمیم چگونه ضرایب را در معادلات شیمیایی از نوع ردوکس قرار دهیم.
فرض کنید نمودار زیر به ما داده شده است:
P + HNO3 = NO2 +…+…
فسفر که طبق تعریف یک ماده ساده است، خواص کاهشی از خود نشان می دهد و حالت اکسیداسیون را به 5+ افزایش می دهد. بنابراین یکی از مواد مفقود فسفریک اسید H3PO4 خواهد بود. ORR وجود یک عامل کاهنده را فرض می کند که نیتروژن خواهد بود. به اکسید نیتریک (4) تبدیل می شود و NO2 را تشکیل می دهد

برای قرار دادن ضرایب در این واکنش، تراز الکترونیکی را ترسیم می کنیم.
P0 5e = P+5 می دهد
N+5 برابر e = N+4 است
با توجه به اینکه قبلا اسید نیتریکو اکسید نیتروژن (4) باید ضریب 5 داشته باشد، ما واکنش تمام شده را دریافت می کنیم:
P + 5HNO3 =5NO2 + H2O + H3PO4
ضرایب استریوشیمیایی در شیمی امکان حل مسائل مختلف محاسباتی را فراهم می کند.
مثال سوم
با توجه به اینکه چیدمان ضرایب برای بسیاری از دانش آموزان دبیرستانی با مشکل مواجه می شود، لازم است دنباله اقدامات روی نمونه های خاص. ما نمونه دیگری از یک کار را ارائه می دهیم که تکمیل آن نیازمند دانش روش شناسی تنظیم ضرایب در یک واکنش ردوکس است.
H2S + HMnO4 = S + MnO2 +…

ویژگی کار پیشنهادی این است که لازم است محصول واکنش از دست رفته تکمیل شود و تنها پس از آن می توانیم به تنظیم ضرایب اقدام کنیم.
پس از مرتب کردن حالتهای اکسیداسیون هر عنصر در ترکیبات، میتوان نتیجه گرفت که منگنز خاصیت اکسید کنندگی از خود نشان میدهد و ظرفیت آن را کاهش میدهد. توانایی کاهش در واکنش پیشنهادی توسط گوگرد نشان داده می شود که به یک ماده ساده کاهش می یابد. پس از تنظیم تراز الکترونیکی، تنها کاری که باید انجام دهیم این است که ضرایب را در نمودار فرآیند پیشنهادی مرتب کنیم. و انجام شد.
مثال چهارم
معادله شیمیایی زمانی فرآیند کامل نامیده می شود که قانون بقای جرم مواد در آن به طور کامل رعایت شود. چگونه این الگو را بررسی کنیم؟ تعداد اتم هایی از همان نوع که وارد واکنش می شوند باید با تعداد آنها در محصولات واکنش مطابقت داشته باشد. فقط در این مورد می توان در مورد سودمندی تعامل شیمیایی ثبت شده، امکان استفاده از آن برای انجام محاسبات و حل مشکلات محاسباتی صحبت کرد. سطوح مختلفمشکلات در اینجا یک نوع کار است که شامل قرار دادن ضرایب استریوشیمیایی از دست رفته در واکنش است:
Si + …+ HF = H2SiF6 + NO +…

دشواری کار این است که هم مواد اولیه و هم محصولات واکنش از دست رفته اند. پس از تنظیم حالت های اکسیداسیون همه عناصر، می بینیم که اتم سیلیکون در کار پیشنهادی خواص کاهشی از خود نشان می دهد. نیتروژن (II) در میان محصولات واکنش وجود دارد؛ یکی از ترکیبات آغازین اسید نیتریک است. ما به طور منطقی تعیین می کنیم که محصول گمشده واکنش آب است. مرحله نهایی قرار دادن ضرایب استریوشیمیایی حاصل در واکنش خواهد بود.
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8 H2O
مثالی از مسئله معادله
برای خنثی کردن کامل هیدروکسید کلسیم تشکیل شده در طول هیدرولیز کاربید آن، باید حجم محلول کلرید هیدروژن 10% را که چگالی آن 1.05 گرم در میلی لیتر است، تعیین کرد. مشخص است که گاز آزاد شده در طول هیدرولیز حجم 8.96 لیتر (n.s.) را اشغال می کند. برای انجام این کار، ابتدا باید یک معادله برای فرآیند هیدرولیز کاربید کلسیم ایجاد کنید:
CaC2 + 2H2O = Ca (OH)2 + C2H2
هیدروکسید کلسیم با کلرید هیدروژن واکنش می دهد، خنثی سازی کامل رخ می دهد:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

ما جرم اسیدی را که برای این فرآیند لازم است محاسبه می کنیم.
ضرایب و شاخص ها در معادلات شیمیایی
حجم محلول هیدروژن کلرید را تعیین کنید. تمام محاسبات برای مشکل با در نظر گرفتن ضرایب استریوشیمیایی انجام می شود که اهمیت آنها را تأیید می کند.
سرانجام
تجزیه و تحلیل نتایج آزمون دولتی یکپارچه در شیمی نشان می دهد که وظایف مربوط به تنظیم ضرایب استریوشیمیایی در معادلات، ترسیم تعادل الکترونیکی، تعیین یک عامل اکسید کننده و یک عامل کاهنده مشکلات جدی برای فارغ التحصیلان مدرن ایجاد می کند. مدارس متوسطه. متأسفانه، میزان استقلال فارغ التحصیلان مدرن تقریباً حداقل است، بنابراین دانش آموزان دبیرستانی مبنای نظری پیشنهادی معلم را تمرین نمی کنند.
در میان اشتباهات معمولیخطاهای ریاضی زیادی وجود دارد که دانش آموزان مدرسه هنگام تنظیم ضرایب در واکنش های مختلف مرتکب می شوند. به عنوان مثال، همه نمی دانند چگونه می توانند کمترین مضرب مشترک را پیدا کنند یا اعداد را به درستی تقسیم و ضرب کنند. دلیل این پدیده کاهش تعداد ساعات اختصاص داده شده به مدارس آموزشیبرای مطالعه این موضوع در برنامه پایهدر شیمی، معلمان این فرصت را ندارند که با دانش آموزان خود مسائل مربوط به آماده سازی تعادل الکترونیکی در فرآیند ردوکس را حل کنند.
تحصیلات
مربع چیست؟ چگونه رئوس، مقطع، صفحه، معادله، حجم، مساحت پایه و زاویه یک مربع را پیدا کنیم؟
پاسخ های زیادی برای این سوال که مربع چیست می تواند وجود داشته باشد. همه چیز بستگی به این دارد که شما این سوال را با چه کسی مطرح کرده اید. یک نوازنده خواهد گفت که یک مربع 4، 8، 16، 32 میله یا بداهه نوازی جاز است. بچه - این چیه...
ماشین ها
هر چند وقت یکبار باید ضدیخ را در خودرو تعویض کنید؟
زمانی که موتور خودرو کار می کند دمای گازهای داخل سیلندرهای آن به 2000 درجه می رسد. به همین دلیل گرمایش قوی قطعات واحد نیرو اتفاق می افتد. برای از بین بردن گرمای اضافی موتور ...
ماشین ها
ترموستات در خودرو چگونه کار می کند؟ اصول کارکرد، اصول جراحی، اصول عملکرد
هیچ ماشین مدرنی نمی تواند بدون سیستم خنک کننده کار کند. این اوست که هنگام پردازش مخلوط قابل احتراق تمام گرمای حاصل از موتور را می گیرد. پیستون ها حرکت می کنند، مخلوط می سوزد، بنابراین شما نیاز به یک ...
ماشین ها
چگونه کولر گازی را در ماشین با دستان خود شارژ کنیم؟ هر چند وقت یک بار نیاز به شارژ مجدد کولر ماشین خود دارید؟ از کجا می توانم کولر خودروی خود را شارژ کنم؟
تهویه مطبوع خودرو امروزه فقط یک لوکس نیست، بلکه یک وسیله ضروری برای یک وسیله نقلیه است که مسئول یک میکروکلیم مطلوب در کابین است. تقریبا همه چیز مدل های مدرنماشین ها مجهز هستند، اگر نه کنترل آب و هوا...
ماشین ها
چگونه کولر گازی را در ماشین با دست خود تمیز کنیم؟
صاحبان خودرو باید دائماً مراقب وضعیت قطعات و مکانیسم های اصلی وسیله نقلیه خود باشند. پس از همه، تمیز نگه داشتن آنها و در شرایط خوب به شما این امکان را می دهد که به دست آورید سطح بهینهایمنی...
ماشین ها
روغن انتقال 80W90: ویژگی ها، انتخاب، بررسی. در گیربکس دستی چه نوع روغنی بریزیم؟
روغن گیربکس 80W90 که ویژگی های آن را امروز در نظر خواهیم گرفت را می توان به عنوان متوسط بین کلاس های ویسکوزیته 85W90 و 75W90 طبقه بندی کرد. بیایید با جزئیات بیشتری دریابیم که چه ویژگی های کیفی با یکدیگر متفاوت است ...
ماشین ها
چه نوع روغنی در فرمان برقی بریزم؟ نکاتی برای تعویض روغن فرمان برقی
فرمان برقی مانند سایر اجزا و مجموعه های خودرو نیاز به تعمیر و نگهداری دوره ای دارد. اغلب، تمام اقدامات پیشگیرانه به جایگزینی مایع کار می شود. اغلب شما فقط نیاز دارید ...
ماشین ها
نحوه پرداخت هزینه پارکینگ در مسکو؟ قوانین پارکینگ پولی
قوانین پارکینگ پولی ایجاد شده است تا زندگی را برای رانندگان مسکو آسان تر کند. بر کسی پوشیده نیست که پارک کردن یک وسیله نقلیه در پایتخت به هیچ وجه آسان نیست: کنار جاده های شهر مملو از اتومبیل است…
ماشین ها
چگونه با دستان خود طعم ماشین درست کنید
هر صاحب ماشینی دوست دارد رایحه ای دلپذیر و مورد علاقه همیشه در فضای داخلی اسب آهنی او وجود داشته باشد. برخی از مردم بوی قهوه را دوست دارند، برخی مرکبات را دوست دارند و برخی تازه را دوست دارند. چه طعم دهنده هایی ...
ماشین ها
چگونه باتری را در خانه شارژ کنیم؟
احتمالا هر صاحب خودرو با مشکل باتری مرده مواجه شده است. اگر به منبع برق خودرو توجه کافی نداشته باشید این مشکل برای هر راننده ای ممکن است پیش بیاید. ما در مورد…
انتخاب 1
الف) Na + O2 -> Na2O د) H2 + F2 -> HF
ب) CaCO3-> CaO + CO2 ه) H2O + K2O -> KOH
ج) روی + H2SO4 -> H2 + ZnSO4 ه) Cu(OH)2 + HNO3 -> Cu(NO3)2 + H2O
درس 13. نوشتن معادلات شیمیایی
تعاریف را بنویسید:
الف) واکنش ترکیبی ب) واکنش گرمازا ج) واکنش برگشت ناپذیر.
الف) کربن با اکسیژن واکنش می دهد و مونوکسید کربن (II) تشکیل می شود.
ب) اکسید منیزیم با اسید نیتریک واکنش می دهد و نیترات منیزیم و آب تشکیل می شود.
ج) هیدروکسید آهن (III) به اکسید آهن (III) و آب تجزیه می شود.
د) متان CH4 در اکسیژن می سوزد و مونوکسید کربن (IV) و آب تولید می کند.
ه) اکسید نیتریک (V) هنگامی که در آب حل می شود اسید نیتریک را تشکیل می دهد.
4. با استفاده از معادله مشکل را حل کنید:
الف) وقتی هیدروژن با فلوئور واکنش می دهد چه حجمی از هیدروژن فلوراید تشکیل می شود؟
ب) در هنگام تجزیه سنگ آهک حاوی 80% CaCO3 چه جرمی از اکسید کلسیم تشکیل می شود؟
ج) با واکنش روی حاوی 35 درصد ناخالصی با اسید سولفوریک چه حجم و جرمی هیدروژن آزاد می شود؟
گزینه 2
- ضرایب را مرتب کنید، نوع واکنش شیمیایی را تعیین کنید، نام مواد را زیر فرمول بنویسید:
الف) P + O2 -> P2O5 د) H2 + N2 -> NH3
ب) CaCO3 + HCl -> CaCl2 + H2O + CO2 ه) H2O + Li2O -> LiOH
ج) Mg + H2SO4 -> H2 + Mg SO4 ه) Ca(OH)2 + HNO3 -> Ca(NO3)2 + H2O
2. تعاریف را بنویسید:
الف) واکنش تجزیه ب) واکنش گرماگیر ج) واکنش کاتالیزوری.
3. معادلات را به شرح زیر بنویسید:
الف) کربن با اکسیژن واکنش می دهد و مونوکسید کربن (IV) تشکیل می شود.
ب) اکسید باریم با اسید نیتریک واکنش داده و نیترات باریم و آب تشکیل می شود.
ج) هیدروکسید آلومینیوم به اکسید آلومینیوم و آب تجزیه می شود.
د) آمونیاک NH3 در اکسیژن و نیتروژن و آب می سوزد.
ه) اکسید فسفر (V) هنگامی که در آب حل می شود، اسید فسفریک را تشکیل می دهد.
4-مسئله را با استفاده از معادله حل کنید:
الف) هنگام واکنش هیدروژن با نیتروژن چه حجمی از آمونیاک ایجاد می شود؟
ب) وقتی سنگ مرمر حاوی 80 درصد CaCO3 با اسید کلریدریک واکنش می دهد چه جرمی از کلرید کلسیم تشکیل می شود؟
ج) با واکنش منیزیم حاوی 30 درصد ناخالصی با اسید سولفوریک، چه حجم و جرمی هیدروژن آزاد می شود؟
 چگونه معادلات شیمیایی بنویسیم؟ اول، مهم است که حالت های اکسیداسیون هر عنصر در ترکیب را ترتیب دهیم. فرض کنید این کار داده شده است: "ضرایب در واکنش را مرتب کنید، جاهای خالی را پر کنید، عامل اکسید کننده و عامل کاهنده را تعیین کنید." یکی از محصولات گم شده آب است و دومی سولفات پتاسیم است. پس از تدوین تراز الکترونیکی، مرحله نهایی تعیین ضرایب در معادله خواهد بود. تمام محاسبات برای مشکل با در نظر گرفتن ضرایب استریوشیمیایی انجام می شود که اهمیت آنها را تأیید می کند. در میان اشتباهات معمولی که دانشآموزان هنگام تنظیم ضرایب در واکنشهای انواع مختلف مرتکب میشوند، خطاهای ریاضی زیادی وجود دارد.
چگونه معادلات شیمیایی بنویسیم؟ اول، مهم است که حالت های اکسیداسیون هر عنصر در ترکیب را ترتیب دهیم. فرض کنید این کار داده شده است: "ضرایب در واکنش را مرتب کنید، جاهای خالی را پر کنید، عامل اکسید کننده و عامل کاهنده را تعیین کنید." یکی از محصولات گم شده آب است و دومی سولفات پتاسیم است. پس از تدوین تراز الکترونیکی، مرحله نهایی تعیین ضرایب در معادله خواهد بود. تمام محاسبات برای مشکل با در نظر گرفتن ضرایب استریوشیمیایی انجام می شود که اهمیت آنها را تأیید می کند. در میان اشتباهات معمولی که دانشآموزان هنگام تنظیم ضرایب در واکنشهای انواع مختلف مرتکب میشوند، خطاهای ریاضی زیادی وجود دارد.
قوانین خاصی وجود دارد که می توان آنها را برای هر عنصر تعیین کرد. فرمول های متشکل از سه عنصر تفاوت های ظریف خود را در محاسبه حالت های اکسیداسیون دارند. بیایید به ادامه گفتگو در مورد چگونگی یکسان سازی معادلات شیمیایی با استفاده از روش تراز الکترونیکی بپردازیم. یک پیش نیاز این است که مقدار هر عنصر را در سمت چپ و راست بررسی کنید. اگر ضرایب به درستی قرار داده شوند، تعداد آنها باید یکسان باشد.
روش جبری
حتماً در مورد آنالیز عنصری مطالعه کنید تا نگاهی عمیق به فرمول های تجربی و تجزیه و تحلیل شیمیایی داشته باشید.
شیمی مواد، خواص و تبدیل آنها را مطالعه می کند. در شکل مولکولی، فرآیند سوزاندن آهن در جو را می توان با استفاده از علائم و نشانه ها بیان کرد. طبق قانون بقای جرم مواد باید جلوی فرمول محصول ضریب 2 گذاشته شود سپس کلسیم بررسی می شود. برای شروع، ما حالت های اکسیداسیون را برای هر یک از عناصر موجود در مواد اولیه و محصولات واکنش تعیین می کنیم. سپس هیدروژن مورد آزمایش قرار می گیرد.
یکسان سازی واکنش های شیمیایی
معادل سازی واکنش های شیمیایی برای به دست آوردن یک واکنش کامل از یک معادله شیمیایی ساده ضروری است. بیایید با کربن شروع کنیم.
قانون بقای جرم، ایجاد اتم های جدید و از بین رفتن اتم های قدیمی را در طی یک واکنش شیمیایی منتفی می کند. به شاخص هر اتم توجه کنید، عدد آنها را نشان می دهد. با اضافه کردن زیرنویس ها در مقابل مولکول های مواد در سمت راست معادله، تعداد اتم های اکسیژن را نیز تغییر دادیم. اکنون تعداد تمام اتم های کربن، هیدروژن و اکسیژن در دو طرف معادله یکسان است.
آنها می گویند اگر عاملی پشت براکت ها باشد، هر عنصر در براکت ها در آن ضرب می شود. شما باید با نیتروژن شروع کنید، زیرا کمتر از اکسیژن و هیدروژن وجود دارد. عالی، هیدروژن برابر شد. بعدی باریم است. برابر است، نیازی به لمس آن نیست. قبل از واکنش دو کلر وجود دارد و بعد از آن فقط یک کلر وجود دارد. چه باید انجام شود؟ حالا با توجه به ضربی که تازه تعیین شد، بعد از واکنش دو سدیم و قبل از واکنش هم دو سدیم گرفتیم. عالی است، همه چیز برابر است. گام بعدی این است که حالت های اکسیداسیون همه عناصر در هر ماده را مرتب کنیم تا بفهمیم اکسیداسیون کجا و کجا کاهش رخ داده است.

نمونه ای از تجزیه و تحلیل واکنش های ساده
در سمت راست هیچ شاخصی وجود ندارد، یعنی یک ذره اکسیژن و در سمت چپ 2 ذره وجود دارد. هیچ نمایه یا اصلاح اضافی در فرمول شیمیاییشما نمی توانید آن را وارد کنید زیرا درست نوشته شده است. در سمت راست، یک در 2 ضرب می کنیم تا 2 یون اکسیژن در آنجا به دست آید.
قبل از شروع کار، باید بدانید که عددی که در مقابل یک عنصر شیمیایی یا کل فرمول قرار می گیرد، ضریب نامیده می شود. بیایید شروع به تجزیه و تحلیل کنیم. بنابراین، نتیجه همان تعداد اتم های هر عنصر قبل و بعد از علامت مساوی است. حتما در نظر داشته باشید که ضریب در شاخص ضرب می شود و اضافه نمی شود.
شما مجاز به استفاده آزادانه از هر سندی برای مقاصد خود با رعایت شرایط زیر هستید:
2) نمادهای عناصر شیمیایی باید دقیقاً به شکلی که در جدول تناوبی ظاهر می شوند نوشته شوند.
کارت اطلاعات. "الگوریتم ترتیب ضرایب در معادلات واکنش شیمیایی."
3) گاهی اوقات شرایطی پیش می آید که فرمول واکنش دهنده ها و محصولات کاملاً درست نوشته شده باشد، اما ضرایب هنوز تخصیص داده نشده اند. این مشکل به احتمال زیاد در واکنش های اکسیداسیون رخ می دهد. مواد آلیکه در آن اسکلت کربن پاره شده است.
شما باید بتوانید نه تنها معادله واکنش را بنویسید، بلکه آن را نیز بخوانید. بنابراین، گاهی اوقات با نوشتن تمام فرمول ها در معادله واکنش، باید تعداد اتم های هر قسمت از معادله را برابر کرده و ضرایب را تنظیم کنید. شمارش کنید که آیا تعداد اتم های هر عنصر در سمت چپ و راست معادله برابر است یا خیر.
برای بسیاری از دانشآموزان، نوشتن معادلات واکنشهای شیمیایی و ترتیب صحیح ضرایب کار آسانی نیست. اما شما فقط باید چند مورد را به خاطر بسپارید قوانین ساده، و کار دیگر مشکلی ایجاد نخواهد کرد. ضریب، یعنی عدد مقابل فرمول مولکول ماده شیمیایی، برای همه کاراکترها اعمال می شود و در هر شاخص هر کاراکتر ضرب می شود!
روش های مختلفی برای تعیین ضرایب در معادلات واکنش های ردوکس وجود دارد. ما از روش تراز الکترونیکی استفاده می کنیم که در آن کامپایل معادله کامل OVR به ترتیب زیر انجام می شود:
1. یک نمودار واکنش ترسیم کنید که موادی را که واکنش داده اند و مواد حاصل از واکنش را نشان می دهد، به عنوان مثال:
2. حالت اکسیداسیون اتم ها را مشخص کنید و علامت و مقدار آن را بالای علامت عناصر بنویسید و به عناصری که حالت اکسیداسیون آنها تغییر کرده است توجه کنید:
3. معادلات الکترونیکی واکنش های اکسیداسیون و احیا را بنویسید، تعداد الکترون های اهدا شده توسط عامل احیا کننده و پذیرفته شده توسط عامل اکسید کننده را تعیین کنید و سپس آنها را با ضرب در ضرایب مناسب برابر کنید:
4. ضرایب به دست آمده مربوط به تراز الکترونیکی به معادله اصلی منتقل می شود:
5. تعداد اتم ها و یون هایی که حالت اکسیداسیون را تغییر نمی دهند (به ترتیب: فلزات، نافلزات، هیدروژن) برابر کنید.
6. صحت انتخاب ضرایب را بر اساس تعداد اتم های اکسیژن در سمت چپ و راست معادله واکنش بررسی کنید - آنها باید برابر باشند (در این معادله 24 = 18 + 2 + 4، 24 = 24).
بیایید به یک مثال پیچیده تر نگاه کنیم:
اجازه دهید حالت های اکسیداسیون اتم ها را در مولکول ها تعیین کنیم:
بیایید معادلات الکترونیکی برای واکنش های اکسیداسیون و کاهش ایجاد کنیم و تعداد الکترون های داده شده و پذیرفته شده را برابر کنیم:
بیایید ضرایب را به معادله اصلی منتقل کنیم:
بیایید تعداد اتم هایی را که حالت اکسیداسیون را تغییر نمی دهند برابر کنیم:
با شمارش تعداد اتم های اکسیژن در سمت راست و چپ معادله، مطمئن می شویم که ضرایب به درستی انتخاب شده اند.
مهمترین عوامل اکسید کننده و کاهنده
خواص ردوکس عناصر به ساختار پوسته الکترونیکی اتم ها بستگی دارد و با موقعیت آنها در جدول تناوبی مندلیف تعیین می شود.
فلزات با داشتن 1-3 الکترون در سطح انرژی بیرونی، به راحتی آنها را رها می کنند و فقط خواص کاهشی از خود نشان می دهند. نافلزات (عناصر گروه های IV-VII) هم می توانند الکترون اهدا کنند و هم می توانند بپذیرند، بنابراین می توانند هم خواص کاهنده و هم اکسید کننده از خود نشان دهند. در دورههایی که تعداد اتمی یک عنصر افزایش مییابد، خواص کاهنده مواد ساده ضعیف میشود و خاصیت اکسیدکننده افزایش مییابد. در گروه هایی که تعداد ترتیبی آنها افزایش می یابد، خاصیت کاهشی افزایش می یابد و خاصیت اکسید کننده ضعیف می شود. بدین ترتیب، از مواد ساده، بهترین عوامل کاهنده فلزات قلیایی، آلومینیوم، هیدروژن، کربن هستند. بهترین عوامل اکسید کننده هالوژن و اکسیژن هستند.
خواص ردوکس مواد پیچیده به درجه اکسیداسیون اتم های سازنده آنها بستگی دارد. موادی که حاوی اتم هایی با کمترین حالت اکسیداسیون هستند، خواص کاهشی از خود نشان می دهند. مهمترین عوامل کاهنده مونوکسید کربن است  ، سولفید هیدروژن
، سولفید هیدروژن  سولفات آهن (II).
سولفات آهن (II).  .موادی که دارای اتم هایی با بالاترین حالت اکسیداسیون هستند، خاصیت اکسید کنندگی از خود نشان می دهند. مهمترین عامل اکسید کننده پرمنگنات پتاسیم است
.موادی که دارای اتم هایی با بالاترین حالت اکسیداسیون هستند، خاصیت اکسید کنندگی از خود نشان می دهند. مهمترین عامل اکسید کننده پرمنگنات پتاسیم است  ، دی کرومات پتاسیم
، دی کرومات پتاسیم  ، آب اکسیژنه
، آب اکسیژنه  ، اسید نیتریک
، اسید نیتریک  ، اسید سولفوریک غلیظ
، اسید سولفوریک غلیظ  .
.
مواد حاوی اتمهایی با حالتهای اکسیداسیون متوسط میتوانند بهعنوان عامل اکسیدکننده یا کاهنده رفتار کنند.بسته به خواص موادی که با آنها تعامل دارند و شرایط واکنش. بنابراین در واکنش با  اسید گوگرد دارای خواص کاهشی است:
اسید گوگرد دارای خواص کاهشی است:
و هنگام تعامل با سولفید هیدروژن یک عامل اکسید کننده است:

علاوه بر این، برای چنین موادی، واکنش های خود اکسیداسیون-خودکاهشی امکان پذیر است که با افزایش و کاهش همزمان حالت اکسیداسیون اتم های همان عنصر رخ می دهد، به عنوان مثال:
قدرت بسیاری از عوامل اکسید کننده و کاهنده به pH محیط بستگی دارد. مثلا، 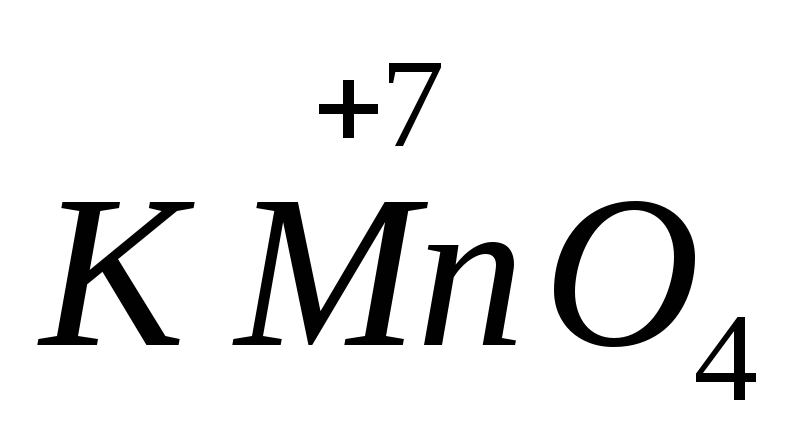 در یک محیط قلیایی کاهش می یابد
در یک محیط قلیایی کاهش می یابد  ، در خنثی به
، در خنثی به  ، در حضور اسید سولفوریک - تا
، در حضور اسید سولفوریک - تا  .
.
الگوریتم
ترتیب ضرایب در معادلات واکنش شیمیایی
معلم شیمی MBOU دبیرستان شماره 2
ولودچنکو سوتلانا نیکولاونا
Ussuriysk
ترتیب ضرایب در معادلات واکنش های شیمیایی
تعداد اتم های یک عنصر در سمت چپ معادله باید با تعداد اتم های آن عنصر در سمت راست معادله برابر باشد.
وظیفه 1 (برای گروه ها).تعداد اتم های هر عنصر شیمیایی شرکت کننده در واکنش را تعیین کنید.
1- تعداد اتم ها را محاسبه کنید:
آ) هیدروژن: 8NH3، NaOH، 6NaOH، 2NaOH،NZRO4، 2H2SO4، 3H2S04، 8H2SO4;
6) اکسیژن: C02، 3C02، 2C02، 6CO، H2SO4، 5H2SO4، 4H2S04، HN03.
2. تعداد اتم ها را محاسبه کنید: الف)هیدروژن:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
ب) اکسیژن:
1) 2СО + 02 2) С02 + 2Н.О. 3) 4NO2 + 2H2O + O2
الگوریتم ترتیب ضرایب در معادلات واکنش شیمیایی
А1 + О2→ А12О3اتم A1-1 A1-2
اتم O-2 O-3
2. از بین عناصر با تعداد اتم های مختلف در قسمت های چپ و راست نمودار، عنصری را انتخاب کنید که تعداد اتم های آن بیشتر باشد.
اتم های O-2 در سمت چپ
اتم های O-3 در سمت راست
3. حداقل مضرب مشترک (LCM) تعداد اتم های این عنصر را در سمت چپ معادله و تعداد اتم های این عنصر را در سمت راست معادله بیابید.
LCM = 6
4. LCM را بر تعداد اتم های این عنصر در سمت چپ معادله تقسیم کنید، ضریب سمت چپ معادله را به دست آورید.
6:2 = 3
Al + ZO 2 → آل 2 در باره 3
5. LCM را بر تعداد اتم های این عنصر در سمت راست معادله تقسیم کنید، ضریب سمت راست معادله را بدست آورید.
6:3 = 2
A1+ O 2 → 2A1 2 O3
6. اگر ضریب مجموعه تعداد اتم های عنصر دیگری را تغییر داده است، مراحل 3، 4، 5 را دوباره تکرار کنید.
A1 + ZO 2 → → 2A1 2 در باره 3
A1 -1 اتم A1 - 4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → → 2A1 2 در باره 3
. آزمون اولیه کسب دانش (8-10 دقیقه .).
دو اتم اکسیژن در سمت چپ نمودار و یک اتم در سمت راست وجود دارد. تعداد اتم ها باید با استفاده از ضرایب برابر شود.
1) 2Mg+O2 → 2MgO
2) CaCO3 + 2HCl→CaCl2 + ن2 O + CO2
وظیفه 2 ضرایب را در معادلات واکنش های شیمیایی قرار دهید (توجه داشته باشید که ضریب تعداد اتم های یک عنصر را تغییر می دهد.):
1. Fe 2 O 3 + A ل → آ ل 2 در باره 3 + آهن؛ Mg+N 2 → Mg 3 ن 2 ;
2. Al + S → ال 2 اس 3 ; A1+ با → ال 4 سی 3 ;
3. Al + Cr 2 O 3 → Cr+Al 2 O 3 ; Ca+P → حدود 3 پ 2 ;
4. C + اچ 2 → CH 4 ; حدود + سی → SaS 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si+Mg → Mg 2 Si;
6/.Na+S → Na 2 S; CaO+ با → CaC 2 + CO؛
7. Ca+N 2 → سی آ 3 ن 2 ; Si+Cl 2 → SiCl 4 ;
8. Ag+S → Ag 2 S; ن 2 + با ل 2 → NS ل
9.N 2 + O 2 → نه CO 2 + با → CO ;
10. سلام → ن 2 → + 1 2 ; Mg+ NS ل → MgCl 2 + ن 2 ;
11.FeS+ NS 1 → FeCl 2 +H 2 S; روی + هیدروکلراید → ZnCl 2 +H 2 ;
12. برادر 2 +KI → KBr+ I 2 ; Si + HF (ر) → SiF 4 +H 2 ;
1./HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+ SO 2 ;
14. کل 2 + KBr → KCl + Br 2 ; SiO 2 + با → Si + CO;
15. SiO 2 + با → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16. Mg 2 سی + HCl → MgCl 2 + SiH 4
1- معادله یک واکنش شیمیایی چیست؟
2. در سمت راست معادله چه نوشته شده است؟ و در سمت چپ؟
3. علامت + در یک معادله به چه معناست؟
4. چرا ضرایب در معادلات شیمیایی قرار می گیرند؟

 ورود
ورود