化学方程式の係数の配置。 情報カード。 「化学反応方程式の係数を並べるアルゴリズム」
最も単純な反応式は次のとおりです。
Fe + S => FeS
反応式は書けるだけでなく読める必要があります。 この方程式は、最も単純な形では次のようになります。鉄分子が硫黄分子と相互作用し、結果として 1 分子の硫化鉄が生成されます。
反応方程式を書く際に最も難しいのは、反応生成物の式を作成することです。 形成された物質。 ここでのルールは 1 つだけです。分子の式は構成要素の価数に厳密に従って構築されるということです。
さらに、反応方程式を作成するときは、物質の質量保存の法則を覚えておく必要があります。つまり、出発物質の分子のすべての原子が反応生成物の分子に含まれていなければなりません。 原子が 1 つも消えたり、予期せず現れたりしてはなりません。 したがって、場合によっては、反応方程式にすべての式を記述した後、方程式の各部分の原子の数を均等にし、係数を設定する必要があります。 以下に例を示します。
C + O 2 => CO 2ここで、各要素は方程式の右側と左側の両方に同じ数の原子を持ちます。 方程式が完成しました。
Cu+O 2 => CuO
そしてここでは、方程式の右側よりも左側の方が酸素原子の数が多くなります。 非常に多くの酸化銅分子を得る必要がある
CuO , 同じ数、つまり 2 個の酸素原子が含まれるようにします。 したがって、式はCuO 係数 2 を設定します:Cu+O2 => 2CuO
さて、銅原子の数は同じではありません。 方程式の左側、銅記号の前に係数 2 を入れます。
2Cu+O2 => 2CuO
方程式の左側と右側にある各要素の原子の数が等しいかどうかを数えます。 「はい」の場合、反応式は正しいことになります。
もう 1 つの例: Al+O 2 = アル 2 ○ 3
そして、これが各元素の原子です 異なる量反応前と反応後。 ガス、つまり酸素分子を使ってレベリングを開始します。
1つ残り 酸素原子が 2 つ、右側が 3 つです。 これら 2 つの数値の最小公倍数を探します。 これ 最小の数、これは 2 と 3 の両方で割り切れます、つまり 6 です。 酸素と酸化アルミニウムの式の前アル 2 ○ 3 これらの分子内の酸素原子の総数が 6 になるように係数を設定します。
アル+ 3O2= 2Al2O 3
2) アルミニウム原子の数を数えます。左側には 2 つの分子に 1 つの原子があり、右側には 2 つの原子、つまり 4 つの原子があります。 方程式の左側のアルミニウム記号の前に係数 4 を置きます。
4Al+3O 2 => 2 Al2O3
3) もう一度、反応の前後ですべての原子を数えます。アルミニウム原子が 4 個、酸素原子が 6 個ずつです。
すべてが順調で、反応方程式は正しいです。 加熱時に反応が起こる場合は、矢印の上に追加の記号が表示されます。 t.
化学反応方程式とは、化学反応の進行を化学式と係数を用いて記録したものです。
係数の範囲
方程式の左側にある 1 つの要素の原子の数は、方程式の右側にあるその要素の原子の数と等しくなければなりません。
タスク 1 (グループ用)。それぞれの原子の数を決定します 化学元素反応に関与している。
1. 原子の数を計算します。
a) 水素: 8NH3、NaOH、6NaOH、2NaOH、H3PO4、2H2SO4、3H2SO4、8H2SO4;
6) 酸素:C02、3C02、2C02、6CO、H2SO4、5H2SO4、4H2S04、HN03。
2. 原子の数を計算します。 a)水素:
1) NaOH + HCl 2) CH4+H2O 3) 2Na+H2
b) 酸素:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
方程式に係数を配置するためのアルゴリズム 化学反応
А1 + О2→ А12О3A1-1 原子 A1-2
O-2 原子 O-3
2. 要素のうち、 異なる数字図の左側と右側の原子のうち、原子数が多い方を選択してください
左側がO-2原子
右側はO-3原子
3. 方程式の左側にあるこの要素の原子の数と方程式の右側にあるこの要素の原子の数の最小公倍数 (LCM) を求めます。
LCM = 6
4. LCM を方程式の左側にあるこの要素の原子の数で割り、方程式の左側の係数を取得します。
6:2 = 3
Al+ZO 2 →アル 2 について 3
5. LCM を方程式の右側にあるこの要素の原子の数で割り、方程式の右側の係数を取得します。
6:3 = 2
A1+O 2 →2A1 2 O3
6. 設定した係数により他の元素の原子数が変化した場合は、再度手順 3、4、5 を繰り返します。
A1+ZO 2 → →2A1 2 について 3
A1 -1 原子 A1 - 4
LCM = 4
4:1=4 4:4=1
4A1+ZO 2 → →2A1 2 について 3
. 知識習得の一次試験(8~10分) .).
図の左側に酸素原子が 2 つ、右側に 1 つあります。 原子の数は係数を使用して等しくする必要があります。
1)2Mg+O2 →2MgO
2) CaCO3 + 2HCl→CaCl2 + N2 O+CO2
タスク 2 化学反応方程式に係数を配置します (係数は 1 つの元素のみの原子数を変更することに注意してください)):
1.鉄 2 ○ 3 +A 私 → あ 私 2 について 3 +鉄; マグネシウム+窒素 2 → マグネシウム 3 N 2 ;
2.Al+S → アル 2 S 3 ; A1+ と → アル 4 C 3 ;
3. アルミニウム+クロム 2 ○ 3 → Cr+Al 2 ○ 3 ; Ca+P → Ca 3 P 2 ;
4.C+ H 2 → CH 4 ; Ca +C → SaS 2 ;
5.Fe+O 2 → 鉄 3 ○ 4 ; Si+Mg → マグネシウム 2 シ;
6/.Na+S → ナ 2 S; CaO+ と → CaC 2 +CO;
7.Ca+N 2 → C ある 3 N 2 ; Si+Cl 2 → SiCl 4 ;
8.銀+S → 銀 2 S; N 2 + と 私 2 → NS l;
9.N 2 +O 2 → いいえ; CO 2 + と → CO ;
10. こんにちは→ N 2 → + 1 2 ; マグネシウム+ NS 私 → MgCl 2 + N 2 ;
11. FeS+ NS 1 → FeCl 2 +H 2 S; 亜鉛+塩酸 → 亜鉛クロリド 2 +H 2 ;
12. ブル 2 +KI → KBr+I 2 ; Si+HF (r) → SiF 4 +H 2 ;
1./HCl+Na 2 CO 3 → CO 2 +H 2 O+ 塩化ナトリウム; KClO 3 +S → → KCl+SO 2 ;
14.Cl 2 +KBr → KCl+Br 2 ; SiO 2 + と → Si + CO;
15.SiO 2 + と → SiC + CO; Mg+SiO 2 → マグネシウム 2 Si+MgO
16 .
3.方程式の「+」記号は何を意味しますか?
4. 化学方程式に係数が配置されるのはなぜですか?
1. 反応図を作成しましょう。
レッスンの目標。教育的。元素の酸化状態の変化に基づいた化学反応の新しい分類である酸化還元反応 (ORR) を生徒に紹介します。 電子天秤法を使用して係数を配置するように生徒に教えます。
発達的。開発を継続する 論理的思考、分析および比較するスキル、主題への興味を育みます。
教育的。生徒の科学的世界観を形成する。 仕事のスキルを向上させます。
方法と方法論的テクニック。ストーリー、会話、視覚補助のデモンストレーション、 独立した仕事学生。
機器と試薬。ロードス島の巨像の再現、電子天秤法による係数配置アルゴリズム、代表的な酸化剤と還元剤の表、クロスワードパズル。 Fe(釘)、NaOH、CuSO4 の溶液。
授業中
導入部
(モチベーションと目標設定)
教師。 3世紀。 紀元前。 ロードス島には、ヘリオス(ギリシャの太陽神)の巨大な像の形をした記念碑が建てられました。 世界の驚異の一つであるロードス島の巨像の壮大なデザインと完璧な仕上がりは、それを見たすべての人を驚かせました。
この像がどのようなものかは正確にはわかっていませんが、彫刻家ハレットが12年の歳月をかけて制作した高さ約33メートルの青銅製であることがわかっています。
青銅の殻は鉄のフレームに取り付けられていました。 中空の像は底から作り始め、成長するにつれて、より安定させるために石で満たされました。 完成から約50年後、巨像は崩壊した。 地震の際に膝の高さで折れてしまいました。
科学者たちは次のように信じています 本当の理由この奇跡のもろさは金属の腐食によるものでした。 そして、腐食プロセスは酸化還元反応に基づいています。
今日のレッスンでは酸化還元反応について学びます。 「還元剤」と「酸化剤」の概念、還元と酸化のプロセスについて学びます。 酸化還元反応の方程式に係数を置く方法を学びます。 レッスンの日付とトピックをワークブックに書き留めます。
新しい教材の学習
教師は、硫酸銅(II)とアルカリとの相互作用と、同じ塩と鉄との相互作用という 2 つの実証実験を行います。
教師。 実行された反応の分子方程式を書き留めます。 各式では、出発物質と反応生成物の式中の元素の酸化状態を整理します。
生徒は黒板に反応方程式を書き、酸化状態を割り当てます。
教師。 これらの反応では元素の酸化状態は変化しましたか?
学生。 最初の方程式では、元素の酸化状態は変化しませんでしたが、2 番目の方程式では、銅と鉄については変化しました。.
教師。 2 番目の反応は酸化還元反応です。 酸化還元反応を定義してみます。
学生。 反応物および反応生成物を構成する元素の酸化状態の変化をもたらす反応は、酸化還元反応と呼ばれます。
生徒たちは教師の口述に従って、酸化還元反応の定義をノートに書き留めます。
教師。 酸化還元反応の結果、何が起こったのでしょうか? 反応前、鉄の酸化状態は 0 でしたが、反応後は +2 になりました。 ご覧のとおり、酸化状態が増加したため、鉄は 2 つの電子を放棄します。
銅の酸化状態は反応前は+2、反応後は0であり、酸化状態が低下していることがわかります。 したがって、銅は2つの電子を受け取ります。
鉄は電子を供与し、還元剤であり、電子を伝達するプロセスは酸化と呼ばれます。
銅は電子を受け取り、酸化剤であり、電子を加えるプロセスは還元と呼ばれます。
これらのプロセスの図を書き留めてみましょう。
そこで、「還元剤」と「酸化剤」という概念を定義してみましょう。
学生。 電子を与える原子、分子、またはイオンは還元剤と呼ばれます。
電子を受け取る原子、分子、またはイオンは酸化剤と呼ばれます。
教師。 還元と酸化のプロセスはどのように定義できるのでしょうか?
学生。 還元は、原子、分子、またはイオンが電子を獲得するプロセスです。
酸化は、原子、分子、またはイオンによる電子の移動のプロセスです。
生徒は口述筆記による定義をノートに書き留め、絵を描きます。
覚えて!
電子を与えて酸化します。
電子を受け取って回復します。
教師。 酸化は常に還元を伴い、逆も同様で、還元は常に酸化を伴います。 還元剤によって放棄される電子の数は、酸化剤によって獲得される電子の数に等しい。
酸化還元反応方程式の係数を選択するには、電子平衡と電子イオン平衡 (半反応法) の 2 つの方法が使用されます。
電子天秤方式のみを考えます。 これを行うために、電子天秤法 (ワットマン紙で設計) を使用して係数を配置するアルゴリズムを使用します。
例 電子天秤法を使用してこの反応スキームの係数を整理し、酸化剤と還元剤を決定し、酸化と還元の過程を示します。
Fe2O3 + CO Fe + CO2。
電子天秤法による係数配置アルゴリズムを使用します。
3. 酸化状態を変化させる元素を書き留めてみましょう。
4. 電子方程式を作成して、与えられる電子と受け取られる電子の数を決定しましょう。
5. 与えられる電子の数と受け取られる電子の数は同じでなければなりません。 出発物質も反応生成物もチャージされません。 最小公倍数 (LCM) と追加の係数を選択することで、与えられた電子と受け取った電子の数を等しくします。
6. 結果として得られる乗数は係数です。 係数を反応スキームに転送しましょう。
Fe2O3 + 3CO = 2Fe + 3CO2。
多くの反応において酸化剤または還元剤となる物質は、典型と呼ばれます。
ワットマン紙で作ったテーブルが吊るされています。
教師。 酸化還元反応は非常に一般的です。 それらは腐食プロセスだけでなく、生物体内で起こる発酵、腐敗、光合成、代謝プロセスにも関連しています。 それらは燃料の燃焼中に観察できます。
化学方程式のバランスをとる方法: ルールとアルゴリズム
酸化還元プロセスは、自然界の物質の循環に伴い行われます。
毎日約 200 万トンの硝酸が大気中で生成されていることをご存知ですか?
年間7億トンが、弱い溶液の形で雨とともに地上に降り注ぎます(人間が生産する硝酸は年間わずか3,000万トンです)。
大気圏では何が起こっているのでしょうか?
空気には体積比で窒素 78%、酸素 21%、その他のガス 1% が含まれています。 雷放電の影響下では、地球上では毎秒平均 100 回の稲妻が発生し、窒素分子が酸素分子と相互作用して一酸化窒素 (II) を形成します。
一酸化窒素(II)は、大気中の酸素によって容易に一酸化窒素(IV)に酸化されます。
結果として生じる窒素酸化物 (IV) は、酸素の存在下で大気中の水分と反応し、硝酸に変わります。
NO2 + H2O + O2 HNO3。
これらの反応はすべて酸化還元です。
エクササイズ 。 電子天秤法を使用して与えられた反応スキームの係数を整理し、酸化剤、還元剤、酸化と還元のプロセスを示します。
解決
1. 元素の酸化状態を調べてみましょう。
2. 酸化状態が変化する元素の記号を強調してみましょう。
3. 酸化状態が変化した元素を書き留めてみましょう。
4. 電子方程式を作成しましょう (与えられた電子と受け取った電子の数を決定します)。
5. 与えられる電子の数と受け取られる電子の数は同じです。
6. から係数を転送しましょう 電子回路反応スキームに:
次に、電子天秤法を用いて係数を自主的に整理し、酸化剤、還元剤を決定し、自然界で起こる他の過程における酸化と還元の過程を示してもらいます。
他の 2 つの反応方程式 (係数付き) は次の形式になります。
タスクの正しさはオーバーヘッドプロジェクターを使用してチェックされます。
最後の部分
教師は生徒に、学習した内容に基づいてクロスワード パズルを解くように指示します。 作業の結果は検証のために提出されます。
解決した上で クロスワード、KMnO4、K2Cr2O7、O3という物質が強いことがわかります...(縦(2))。
水平方向:
1. この図はどのようなプロセスを反映していますか:
3. 反応
N2 (g.) + 3H2 (g.) 2NH3 (g.) + Q
酸化還元、可逆性、均質性などです。
4. ... 炭素(II)は典型的な還元剤です。
5. この図はどのようなプロセスを反映していますか:
6. 酸化還元反応方程式の係数を選択するには、電子... 法を使用します。
7. 図によると、アルミニウムは電子を放棄しました。
8. 反応として:
Н2 + Сl2 = 2НCl
水素 H2 – ... 。
9. 常に酸化還元のみとなる反応は何ですか?
10. 単体物質の酸化状態は…。
11. 反応として:
還元剤 -…。
宿題。
O.S. ガブリエルアンの教科書「Chemistry-8」§ 43、p. によると、 178–179、例。 1、7は書面で。 タスク(自宅用)。 最初のデザイナー 宇宙船そして潜水艦は、船内の空気組成をどのようにして一定に維持するかという問題に直面しました。 宇宙ステーション? 余分な二酸化炭素を排出して酸素を補給しますか? 解決策が見つかりました。
超酸化カリウム KO2 は二酸化炭素と反応して酸素を生成します。
ご覧のとおり、これは酸化還元反応です。 この反応における酸素は酸化剤であると同時に還元剤でもあります。
宇宙ミッションでは、貨物のすべてのグラムが重要です。 宇宙飛行が 10 日間続き、乗組員が 2 人の場合、宇宙飛行に摂取しなければならない超酸化カリウムの供給量を計算します。 人は1日に1kgの二酸化炭素を吐き出すことが知られています。
(答え:64.5kg KO2。 )
エクササイズ ( レベルが上がった困難)。 ロードス島の巨像の破壊につながる可能性のある酸化還元反応の方程式を書き留めてください。 この巨大な像が、現在のトルコの沖合にあるエーゲ海の島の港町に立っていたことを覚えておいてください。地中海の湿気の多い空気には塩分が含まれています。 それは青銅(銅と錫の合金)でできており、鉄のフレームに取り付けられていました。
文学
ガブリエルアン O.S.。 化学-8. M.: バスタード、2002 年。
ガブリエルヤン O.S.、ヴォスコボイニコワ N.P.、ヤシュコヴァ A.V.教師用ハンドブック。 8年生。 M.: バスタード、2002 年。
コックス R.、モリス N。 世界の七不思議。 古い世界、中世、私たちの時代。 M.: BMM AO、1997;
小さな子供向けの百科事典。 化学。 M.: ロシア百科事典パートナーシップ、2001 年。 子ども向け百科事典「Avanta+」。 化学。 T. 17. M.: アヴァンタ+、2001;
コムチェンコ G.P.、セバスチャノワ K.I.酸化還元反応。 M.: 教育、1989 年。
S.P.レベシェワ、
第8中学校の化学教師
(バルチースク、カリーニングラード地域)
オッズを選択するためのルール:
- 反応スキームの一方の部分の元素の原子数が偶数で、もう一方の元素の原子数が奇数の場合、奇数の原子数を含む式の前に係数 2 を入力し、次にすべての原子数を入力する必要があります。原子は均一化されなければなりません。
— 係数の配置は、組成内の最も複雑な物質から始めて、次の順序で行う必要があります。
まず金属原子の数を等しくする必要があり、次に酸残基(非金属原子)、次に水素原子、最後に酸素原子の数を等しくする必要があります。
— 方程式の左側と右側の酸素原子の数が同じであれば、係数は正しく決定されます。
- この後、方程式の部分間の矢印を等号に置き換えることができます。
— 化学反応方程式の係数には公約数があってはなりません。
例。 水酸化鉄 (III) と硫酸が硫酸鉄 (III) を生成する化学反応の方程式を作成してみましょう。
1. 反応図を作成しましょう。
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2. 物質の式に対する係数を選択しましょう。 最も複雑な物質から始めて、スキーム全体を通して、最初に金属原子、次に酸残基、次に水素、そして最後に酸素を順に均等化する必要があることを私たちは知っています。 私たちのスキームでは、最も複雑な物質は Fe2(SO4)3 です。 これには 2 つの鉄原子が含まれており、Fe(OH)3 には 1 つの鉄原子が含まれています。 これは、式 Fe(OH)3 の前に係数 2 を入力する必要があることを意味します。
2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
次に、SO4 の酸性残基の数を均等にしてみましょう。 塩 Fe2(SO4)3 には 3 つの酸性 SO4 残基が含まれています。 これは、式 H2SO4 の前の左側に係数 3 を入れることを意味します。
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O。
次に、水素原子の数を均等にしてみましょう。 図の左側の水酸化鉄 2Fe(OH)3 – 6 個の水素原子 (2
・3)、硫酸3H2SO4にも水素原子が6個あります。
化学方程式に係数を配置する方法
左側には合計12個の水素原子があります。 これは、右側で水の公式 H2O の前に係数 6 を置くことを意味します。そして、右側には 12 個の水素原子もあります。
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O。
酸素原子の数を等しくすることが残っています。 しかし、図の左側と右側の部分にはすでに同じ数の酸素原子 (各部分に 18 個) があるため、これはもう必要ありません。 これは、図が完全に記述されたことを意味し、矢印を等号に置き換えることができます。
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O。
教育
化学方程式に係数を配置するにはどうすればよいですか? 化学方程式
今日はオッズを設定する方法について話します 化学方程式。 この質問は高校生だけではありません。 教育機関だけでなく、複雑な要素と 興味深い科学。 最初の段階で化学方程式の書き方を理解しておけば、将来問題を解くのに困ることはありません。 最初から考えてみましょう。
方程式とは何ですか
これは通常、選択された試薬間で起こる化学反応の従来の記録として理解されています。 このような処理には、指数、係数、式が使用されます。
コンパイルアルゴリズム
化学方程式はどうやって書くのですか? インタラクションの例は、元の接続を合計することで作成できます。 等号は、反応する物質間で相互作用が起こることを示します。 次に、価数(酸化状態)ごとに生成物の式をまとめます。
トピックに関するビデオ
反応を記録する方法
たとえば、メタンの特性を確認する化学方程式を書き留める必要がある場合は、次のオプションを選択します。
- ハロゲン化(VIIA元素とのラジカル相互作用) 周期表 D.I.メンデレーエフ)。
- 空気中の酸素中での燃焼。

最初のケースでは、出発物質を左側に、結果として生じる生成物を右側に書きます。 各化学元素の原子数を確認した後、進行中のプロセスの最終記録を取得します。 メタンが酸素中で燃焼すると、発熱プロセスが発生し、その結果、二酸化炭素と水蒸気が形成されます。
化学方程式の係数を正しく設定するには、物質の質量保存の法則が使用されます。 均等化プロセスは、炭素原子の数を決定することから始まります。 次に、水素の計算を実行し、その後に初めて酸素の量を確認します。
OVR
複雑な化学方程式は、電子バランスまたは半反応法を使用してバランスをとることができます。 以下のタイプの反応に係数を割り当てるように設計された一連のアクションを提供します。

まず、化合物中の各元素の酸化状態を整えることが重要です。 それらを配置するときは、いくつかのルールを考慮する必要があります。
- 単体の場合はゼロです。
- 二項複合では、それらの合計は 0 になります。
- 3 つ以上の元素の化合物では、最初の元素が正の値を示し、最も外側のイオンは - 否定的な意味酸化の程度。 中心要素は、合計が 0 でなければならないことを考慮して数学的に計算されます。
次に、酸化状態が変化した原子またはイオンを選択します。 プラス記号とマイナス記号は、電子の数 (受け取った、与えた) を示します。 次に、それらの間で最小の倍数が決定されます。 NOCをこれらの数値で割ると数値が得られます。 このアルゴリズムは、化学方程式に係数をどのように配置するかという問題に対する答えになります。
最初の例
「反応の係数を整理し、空白を埋め、酸化剤と還元剤を決定してください」という課題が与えられたとします。 このような例は、統一国家試験として化学を選択した学校卒業生に提供されます。
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 +…+…

将来のエンジニアや医師に提供される化学方程式に係数を配置する方法を理解してみましょう。 原料や製品中の元素の酸化状態を整理すると、マンガンイオンは酸化剤として作用し、臭化物イオンは還元性を示すことが分かりました。
我々は、見逃された物質は酸化還元プロセスに関与していないと結論付けています。 不足している生成物の 1 つは水で、2 番目は硫酸カリウムになります。 電子天秤をコンパイルした後の最終段階では、方程式の係数を設定します。
2番目の例
酸化還元タイプの化学方程式に係数を配置する方法を理解するために別の例を示します。
次の図が与えられたとします。
P + HNO3 = NO2 +…+…
定義上、単体の物質であるリンは還元特性を示し、酸化状態を +5 まで高めます。 したがって、不足する物質の 1 つはリン酸 H3PO4 になります。 ORR は還元剤 (窒素) の存在を前提としています。 一酸化窒素 (4) に変化し、NO2 を形成します。

この反応に係数を与えるために、電子天秤を作成します。
P0 は 5e = P+5 を与えます
N+5 は e = N+4 を受け取ります
先ほどのことを考えると 硝酸窒素酸化物 (4) の係数は 5 であるはずで、完成した反応が得られます。
P + 5HNO3 =5NO2 + H2O + H3PO4
化学における立体化学係数を使用すると、さまざまな計算問題を解くことができます。
3番目の例
係数の配置が多くの高校生にとって難しいことを考慮すると、一連の動作を練習する必要があります。 具体的な例。 タスクの別の例を紹介します。このタスクを完了するには、酸化還元反応で係数を配置するための方法論の知識が必要です。
H2S + HMnO4 = S + MnO2 +…

提案されたタスクの特徴は、不足している反応生成物を補う必要があり、その後でのみ係数の設定に進むことができることです。
化合物中の各元素の酸化状態を整理すると、マンガンは酸化特性を示し、価数を下げると結論付けることができます。 提案された反応における還元能力は、単体に還元される硫黄によって実証されます。 電子天秤をコンパイルしたら、提案されたプロセス図に係数を配置するだけです。 そして完了です。
4番目の例
化学方程式は、その中で物質の質量保存の法則が完全に観察されるとき、完全な過程と呼ばれます。 このパターンを確認するにはどうすればよいですか? 反応に関与した同じ種類の原子の数は、反応生成物内の原子の数に対応する必要があります。 この場合にのみ、記録された化学相互作用の有用性、計算の実行および計算問題の解決への使用の可能性について話すことができます。 さまざまなレベル困難。 以下は、不足している立体化学係数を反応に配置するタスクの変形例です。
Si + …+ HF = H2SiF6 + NO +…

この作業の難しさは、出発物質と反応生成物の両方が欠落していることです。 すべての元素の酸化状態を設定した後、提案されたタスクのシリコン原子が還元特性を示すことがわかります。 反応生成物中には窒素 (II) が存在し、出発化合物の 1 つは硝酸です。 反応で不足している生成物は水であると論理的に判断します。 最終段階では、得られた立体化学係数を反応に配置します。
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O
方程式問題の例
炭化物の加水分解中に形成される水酸化カルシウムを完全に中和するために必要な、密度が 1.05 g/ml の 10% 塩化水素溶液の体積を決定する必要があります。 加水分解中に放出されるガスの体積は 8.96 リットル (n.s.) であることが知られています。この課題に対処するには、まず炭化カルシウムの加水分解プロセスの方程式を作成する必要があります。
CaC2 + 2H2O = Ca(OH)2 + C2H2
水酸化カルシウムは塩化水素と反応し、完全な中和が起こります。
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

このプロセスに必要な酸の質量を計算します。
化学方程式の係数と指数
塩化水素溶液の量を測定します。 この問題のすべての計算は立体化学係数を考慮して実行され、その重要性が確認されます。
ついに
化学の統一国家試験の結果を分析したところ、方程式の立体化学係数の設定、電子天秤の作成、酸化剤と還元剤の決定に関連する課題が現代の卒業生にとって深刻な困難を引き起こしていることが示されています。 中学校。 残念なことに、現代の卒業生の独立性の度合いはほぼ最小限であるため、高校生は教師が提案した理論的基礎を実践していません。
の間で 典型的な間違いさまざまなタイプの反応で係数を配置するときに、小学生が犯す数学的間違いは数多くあります。 たとえば、最小公倍数を見つける方法や、数値の除算と乗算を正しく行う方法を誰もが知っているわけではありません。 この現象の原因は、業務に割り当てられる時間数の減少です。 教育学校このトピックを勉強するために。 で 基本プログラム化学では、教師は酸化還元プロセスにおける電子天秤の準備に関連する問題を生徒と一緒に解決する機会がありません。
教育
正方形とは何ですか? 正方形の頂点、断面、平面、方程式、体積、底面積、角度を見つけるにはどうすればよいですか?
正方形とは何かという質問には多くの答えがあります。 それはすべて、この質問を誰に宛てたのかによって異なります。 ミュージシャンは、正方形は 4、8、16、32 小節、またはジャズの即興演奏であると言うでしょう。 子供「これは何ですか...」
車
車の不凍液はどのくらいの頻度で交換する必要がありますか?
車のエンジンが作動すると、シリンダー内のガスの温度は 2000 度に達します。 このため、パワーユニット部品が強く発熱します。 エンジンの余分な熱を取り除くために...
車
車のサーモスタットはどのように機能しますか? 動作原理
現代の車は冷却システムなしでは成り立ちません。 可燃性混合物を処理するときにエンジンから発せられる熱をすべて引き受けるのは彼女です。 ピストンが動き、混合物が燃焼するので、十分な温度が必要です...
車
車のエアコンを自分の手で充電するにはどうすればよいですか? 車のエアコンはどのくらいの頻度で充電する必要がありますか? 車のエアコンはどこで充電できますか?
今日のカーエアコンは単なる贅沢品ではなく、車内の微気候を良好に保つ役割を果たす車両にとって必要な装置です。 ほとんど全て 現代のモデル車にはエアコンが装備されていないとしても...
車
車のエアコンを自分の手で掃除するにはどうすればよいですか?
車の所有者は、車の主要部品や機構の状態に常に注意を払う必要があります。 結局のところ、それらを清潔で良好な状態に保つことで、 最適レベル安全性...
車
トランスミッションオイル80W90:特徴、選択、レビュー。 マニュアルトランスミッションにはどのようなオイルを入れればよいですか?
今日私たちがその特性を検討するトランスミッションオイル80W90は、粘度クラス85W90と75W90の間の平均として分類できます。 お互いにどのような質的特徴が異なるのかを詳しく見てみましょう...
車
パワステにはどのようなオイルを入れればよいのでしょうか? パワーステアリングオイル交換のコツ
パワーステアリングは、車の他のコンポーネントやアセンブリと同様、定期的なメンテナンスが必要です。 多くの場合、すべての予防策は作動流体の交換に帰着します。 多くの場合、必要なのは...
車
モスクワの駐車料金の支払い方法は? ルール 有料駐車場
モスクワのドライバーの生活をより楽にするために設けられた有料駐車規則があります。 首都で車を駐車するのが決して簡単ではないことは周知の事実です。市内の道端は車で混雑しています…
車
自分の手で車のフレーバーを作る方法
すべての車の所有者は、快適でお気に入りの香りが常に自分の鉄馬の車内に存在することを望んでいます。 コーヒーの香りが好きな人もいれば、柑橘類が好きな人も、爽やかさが好きな人もいます。 いったいどんな味付けなんだろう…
車
自宅でバッテリーを充電するにはどうすればよいですか?
おそらくすべての車の所有者は、バッテリー切れの問題に遭遇したことがあります。 このトラブルは、車の電源に十分な注意を払わないと、どのドライバーにも発生する可能性があります。
オプション1
a) Na + O2 -> Na2O d) H2 + F2 -> HF
b) CaCO3 -> CaO + CO2 e) H2O + K2O -> KOH
c) Zn + H2SO4 -> H2 + ZnSO4 e) Cu(OH)2 + HNO3 -> Cu(NO3)2 + H2O
レッスン 13. 化学方程式の書き方
定義を書き留めます。
a) 複合反応 b) 発熱反応 c) 不可逆反応。
a) 炭素が酸素と反応し、一酸化炭素 (II) が形成されます。
b) 酸化マグネシウムは硝酸と反応し、硝酸マグネシウムと水が形成されます。
c) 水酸化鉄(III)は酸化鉄(III)と水に分解する。
d) メタン CH4 は酸素中で燃焼し、一酸化炭素 (IV) と水が生成されます。
e) 一酸化窒素 (V) は水に溶解すると硝酸を形成します。
4. 次の方程式を使用して問題を解きます。
a) 水素がフッ素と反応すると、どのくらいの量のフッ化水素が生成されますか?
b) 80% CaCO3 を含む石灰石の分解中に生成される酸化カルシウムの質量はどれですか?
c) 35% の不純物を含む亜鉛が硫酸と反応すると、どのくらいの体積と質量の水素が放出されますか?
オプション 2
- 係数を整理し、化学反応の種類を決定し、式の下に物質の名前を書き留めます。
a) P + O2 -> P2O5 d) H2 + N2 -> NH3
b) CaCO3 + HCl -> CaCl2 + H2O + CO2 e) H2O + Li2O -> LiOH
c) Mg + H2SO4 -> H2 + Mg SO4 e) Ca(OH)2 + HNO3 -> Ca(NO3)2 + H2O
2. 定義を書き留めます。
a) 分解反応 b) 吸熱反応 c) 触媒反応。
3. 説明に従って式を書き留めます。
a) 炭素が酸素と反応し、一酸化炭素 (IV) が形成されます。
b) 酸化バリウムは硝酸と反応し、硝酸バリウムと水が生成されます。
c) 水酸化アルミニウムは酸化アルミニウムと水に分解します。
d) アンモニア NH3 が酸素中で燃焼し、窒素と水が生成される。
e) 酸化リン (V) は、水に溶解するとリン酸を形成します。
4. 次の方程式を使用して問題を解きます。
a) 水素が窒素と反応すると、どのくらいの量のアンモニアが生成されますか?
b) 80% CaCO3 を含む大理石が塩酸と反応すると、どのくらいの質量の塩化カルシウムが形成されますか?
c) 30%の不純物を含むマグネシウムが硫酸と反応すると、どのくらいの体積と質量の水素が放出されますか?
 化学方程式はどうやって書くのですか? まず、化合物中の各元素の酸化状態を整えることが重要です。 「反応の係数を整理し、空白を埋め、酸化剤と還元剤を決定してください」という課題が与えられたとします。 不足している生成物の 1 つは水で、2 番目は硫酸カリウムになります。 電子天秤をコンパイルした後の最終段階では、方程式の係数を設定します。 この問題のすべての計算は立体化学係数を考慮して実行され、その重要性が確認されます。 さまざまなタイプの反応で係数を配置するときに、学童が犯す典型的な間違いの中には、多くの数学的間違いがあります。
化学方程式はどうやって書くのですか? まず、化合物中の各元素の酸化状態を整えることが重要です。 「反応の係数を整理し、空白を埋め、酸化剤と還元剤を決定してください」という課題が与えられたとします。 不足している生成物の 1 つは水で、2 番目は硫酸カリウムになります。 電子天秤をコンパイルした後の最終段階では、方程式の係数を設定します。 この問題のすべての計算は立体化学係数を考慮して実行され、その重要性が確認されます。 さまざまなタイプの反応で係数を配置するときに、学童が犯す典型的な間違いの中には、多くの数学的間違いがあります。
要素ごとにそれらを決定できる特定のルールがあります。 3 つの要素で構成される式には、酸化状態の計算において独自のニュアンスがあります。 電子天秤法を使用して化学方程式を等化する方法についての会話を続けましょう。 前提条件は、左側と右側の各要素の数量を確認することです。 係数が正しく配置されていれば、その数は同じになるはずです。
代数的手法
経験式と化学分析について詳しく知るために、元素分析について必ず読んでください。
化学は、物質、その特性、および変換を研究します。 大気中で鉄が燃える過程を分子の形で記号や記号で表現することができます。 物質の質量保存の法則により、積式の前に係数 2 を付ける必要があります。次にカルシウムをチェックします。 まず、出発物質と反応生成物の各元素の酸化状態を割り当てます。 次に、水素をテストします。
化学反応の均一化
単純な化学方程式から完全な化学反応を得るには、化学反応を等式化する必要があります。 まずはカーボンから始めましょう。
質量保存の法則では、化学反応中の新しい原子の生成と古い原子の破壊は除外されます。 各原子のインデックスに注目してください。これは原子の番号を示しています。 式の右側の物質の分子の前に下付き文字を追加することで、酸素原子の数も変更しました。 これで、すべての炭素、水素、酸素原子の数は方程式の両側で同じになります。
係数が括弧の後ろにある場合、括弧内の各要素にその係数が乗算されると言われています。 酸素や水素よりも窒素の量が少ないため、窒素から始める必要があります。 すごい、水素が均一になりました。 次はバリウムです。 イコライズされているので、触れる必要はありません。 反応前には塩素が 2 つありますが、反応後は 1 つだけになります。 何をする必要があるでしょうか? さて、設定したばかりの係数により、反応後にナトリウムが 2 つ得られ、反応前にもナトリウムが 2 つ得られます。 素晴らしい、他はすべて均等化されています。 次のステップは、各物質のすべての元素の酸化状態を整理して、どこで酸化が起こり、どこで還元が起こったかを理解することです。

単純な反応の解析例
右側、つまり酸素の 1 つの粒子にはインデックスはありませんが、左側には 2 つの粒子があります。 追加のインデックスや修正はありません 化学式正しく書いてあるので入力できません。 右側では、1 と 2 を掛けて、2 つの酸素イオンを取得します。
タスク自体を開始する前に、化学元素または式全体の前に置かれる数字が係数と呼ばれることを理解する必要があります。 分析を始めましょう。 したがって、結果は等号の前後で各要素の原子の数が同じになります。 係数はインデックスに乗算されるものであり、加算されるものではないことに注意してください。
以下の条件に従って、あらゆる文書を自分自身の目的のために自由に使用することが許可されています。
2) 化学元素の記号は、周期表に表示される形式で厳密に記述する必要があります。
情報カード。 「化学反応方程式の係数を並べるアルゴリズム」
3) 反応物と生成物の式が完全に正しく記述されていても、係数がまだ割り当てられていない状況が時々発生します。 この問題は酸化反応で発生する可能性が最も高くなります。 有機物炭素の骨格が引き裂かれる状態です。
反応式は書けるだけでなく読める必要があります。 したがって、場合によっては、反応方程式にすべての式を記述した後、方程式の各部分の原子の数を均等にし、係数を設定する必要があります。 方程式の左側と右側にある各要素の原子の数が等しいかどうかを数えます。
多くの学童にとって、化学反応の方程式を書き、係数を正しく配置することは簡単な作業ではありません。 ただし、いくつか覚えておく必要があるだけです 簡単なルール、そしてそのタスクはもはや困難を引き起こしません。 係数、つまり分子の式の前にある数字 化学物質、すべての文字に適用され、すべての文字のすべてのインデックスが乗算されます。
酸化還元反応方程式の係数を決定するにはいくつかの方法があります。 電子天秤法を使用し、完全な OVR 方程式の作成が次の順序で実行されます。
1. 反応した物質と反応の結果生じた物質を示す反応図を作成します。次に例を示します。
2. 原子の酸化状態を決定し、その符号と値を元素記号の上に書き込み、酸化状態が変化した元素に注目します。
3. 酸化反応と還元反応の電子方程式を書き留め、還元剤によって供与され、酸化剤によって受け取られる電子の数を決定し、適切な係数を乗算してそれらを等しくします。
4. 電子天秤に対応する取得された係数は主方程式に転送されます。
5. 酸化状態を変化させない原子とイオンの数を等しくします (金属、非金属、水素の順)。
6. 反応式の左側と右側の酸素原子の数に基づいて係数の選択が正しいかどうかを確認します。それらは等しいはずです (この式では 24 = 18 + 2 + 4、24 = 24)。
より複雑な例を見てみましょう。
分子内の原子の酸化状態を決定してみましょう。
酸化と還元反応の電子方程式を作成し、与えられる電子と受け取られる電子の数を等しくしましょう。
係数を主方程式に転送しましょう。
酸化状態を変えない原子の数を等しくしてみましょう。
方程式の右側と左側の酸素原子の数を数えることによって、係数が正しく選択されていることを確認します。
最も重要な酸化剤と還元剤
元素の酸化還元特性は原子の電子殻の構造に依存し、メンデレーエフの周期表における位置によって決まります。
金属は外部エネルギー準位に 1 ~ 3 個の電子を持っているため、簡単に電子を放棄し、還元特性のみを示します。 非金属 (IV ~ VII 族の元素) は電子を供与することも受容することもできるため、還元性と酸化性の両方の特性を示すことができます。 元素の原子番号が増加すると、単体の物質の還元性が弱まり、酸化性が増加します。 序数が大きくなる群では還元性が強くなり、酸化性が弱まります。 したがって、 単体の場合、最良の還元剤はアルカリ金属、アルミニウム、水素、炭素です。 最良の酸化剤はハロゲンと酸素です.
複雑な物質の酸化還元特性は、それらを構成する原子の酸化の程度によって異なります。 酸化状態が最も低い原子を含む物質は還元特性を示します。。 最も重要な還元剤は一酸化炭素です  、硫化水素
、硫化水素  、硫酸鉄(II)
、硫酸鉄(II)  .最も高い酸化状態の原子を含む物質は酸化特性を示します。。 最も重要な酸化剤は過マンガン酸カリウムです
.最も高い酸化状態の原子を含む物質は酸化特性を示します。。 最も重要な酸化剤は過マンガン酸カリウムです  、重クロム酸カリウム
、重クロム酸カリウム  、 過酸化水素
、 過酸化水素  、 硝酸
、 硝酸  、濃硫酸
、濃硫酸  .
.
中間酸化状態の原子を含む物質は、酸化剤または還元剤として作用することができます。相互作用する物質の性質と反応条件に応じて異なります。 それで、それに反応して  亜硫酸は還元特性を示します。
亜硫酸は還元特性を示します。
硫化水素と相互作用すると酸化剤になります。

さらに、そのような物質では、同じ元素の原子の酸化状態の増加と減少を同時に伴う自己酸化自己還元反応が発生する可能性があります。以下に例を示します。
多くの酸化剤と還元剤の強度は培地の pH に依存します。 例えば、 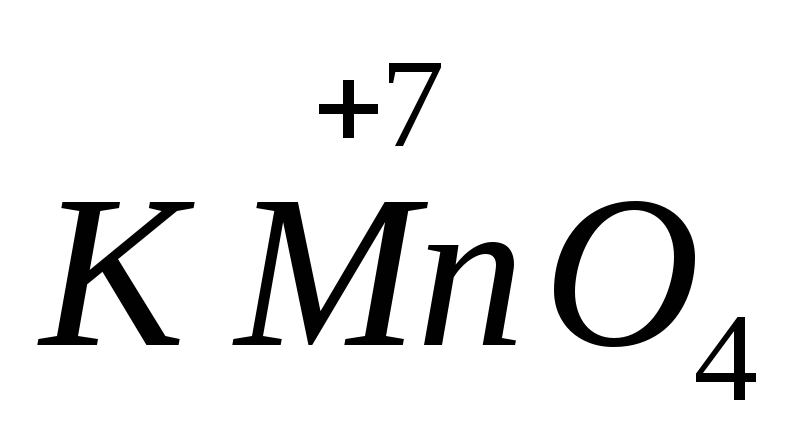 アルカリ性環境では、次のように還元されます。
アルカリ性環境では、次のように還元されます。  、ニュートラルで
、ニュートラルで  、硫酸の存在下 - まで
、硫酸の存在下 - まで  .
.
アルゴリズム
化学反応方程式の係数の整理
MBOU中等教育学校第2校 化学教師
ヴォロドチェンコ・スヴェトラーナ・ニコラエヴナ
ウスリースク
化学反応方程式の係数の配置
方程式の左側にある 1 つの要素の原子の数は、方程式の右側にあるその要素の原子の数と等しくなければなりません。
タスク 1 (グループ用)。反応に関与する各化学元素の原子の数を決定します。
1. 原子の数を計算します。
あ) 水素:8NH3、NaOH、6NaOH、2NaOH、NZRO4、2H2SO4、3H2SO4、8H2SO4;
6) 酸素:C02、3C02、2C02、6CO、H2SO4、5H2SO4、4H2S04、HN03。
2. 原子の数を計算します。 a)水素:
1) NaOH + HCl 2) CH4+H2O 3) 2Na+H2
b) 酸素:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
化学反応方程式の係数を整理するアルゴリズム
А1 + О2→ А12О3A1-1 原子 A1-2
O-2 原子 O-3
2. 図の左右で原子数が異なる元素のうち、原子数が多い方を選択します。
左側がO-2原子
右側はO-3原子
3. 方程式の左側にあるこの要素の原子の数と方程式の右側にあるこの要素の原子の数の最小公倍数 (LCM) を求めます。
LCM = 6
4. LCM を方程式の左側にあるこの要素の原子の数で割り、方程式の左側の係数を取得します。
6:2 = 3
Al+ZO 2 →アル 2 について 3
5. LCM を方程式の右側にあるこの要素の原子の数で割り、方程式の右側の係数を取得します。
6:3 = 2
A1+O 2 →2A1 2 O3
6. 設定した係数により他の元素の原子数が変化した場合は、再度手順 3、4、5 を繰り返します。
A1+ZO 2 → →2A1 2 について 3
A1 -1 原子 A1 - 4
LCM = 4
4:1=4 4:4=1
4A1+ZO 2 → →2A1 2 について 3
. 知識習得の一次試験(8~10分) .).
図の左側に酸素原子が 2 つ、右側に 1 つあります。 原子の数は係数を使用して等しくする必要があります。
1)2Mg+O2 →2MgO
2) CaCO3 + 2HCl→CaCl2 + N2 O+CO2
タスク 2 化学反応方程式に係数を配置します (係数は 1 つの元素のみの原子数を変更することに注意してください)):
1.鉄 2 ○ 3 +A 私 → あ 私 2 について 3 +鉄; マグネシウム+窒素 2 → マグネシウム 3 N 2 ;
2.Al+S → アル 2 S 3 ; A1+ と → アル 4 C 3 ;
3. アルミニウム+クロム 2 ○ 3 → Cr+Al 2 ○ 3 ; Ca+P → Ca 3 P 2 ;
4.C+ H 2 → CH 4 ; Ca +C → SaS 2 ;
5.Fe+O 2 → 鉄 3 ○ 4 ; Si+Mg → マグネシウム 2 シ;
6/.Na+S → ナ 2 S; CaO+ と → CaC 2 +CO;
7.Ca+N 2 → C ある 3 N 2 ; Si+Cl 2 → SiCl 4 ;
8.銀+S → 銀 2 S; N 2 + と 私 2 → NS l;
9.N 2 +O 2 → いいえ; CO 2 + と → CO ;
10. こんにちは→ N 2 → + 1 2 ; マグネシウム+ NS 私 → MgCl 2 + N 2 ;
11.フェス+ NS 1 → FeCl 2 +H 2 S; 亜鉛+塩酸 → 亜鉛クロリド 2 +H 2 ;
12. ブル 2 +KI → KBr+I 2 ; Si+HF (r) → SiF 4 +H 2 ;
1./HCl+Na 2 CO 3 → CO 2 +H 2 O+ 塩化ナトリウム; KClO 3 +S → → KCl+SO 2 ;
14.Cl 2 +KBr → KCl+Br 2 ; SiO 2 + と → Si + CO;
15.SiO 2 + と → SiC + CO; Mg+SiO 2 → マグネシウム 2 Si+MgO
16. マグネシウム 2 シ + 塩酸 → MgCl 2 + SiH 4
1.化学反応の方程式は何ですか?
2.式の右辺には何が書かれていますか? そして左側は?
3.方程式の「+」記号は何を意味しますか?
4. 化学方程式に係数が配置されるのはなぜですか?

 入り口
入り口